+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1fa9 | ||||||
|---|---|---|---|---|---|---|---|
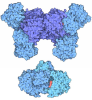
| タイトル | HUMAN LIVER GLYCOGEN PHOSPHORYLASE A COMPLEXED WITH AMP | ||||||
 要素 要素 | GLYCOGEN PHOSPHORYLASE, LIVER FORM | ||||||
 キーワード キーワード | TRANSFERASE / protein-ligand complex / allosteric protein / phosphorylated protein | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報purine nucleobase binding / vitamin binding / D-glucose binding / glycogen phosphorylase / glycogen phosphorylase activity / bile acid binding / glycogen catabolic process / Glycogen breakdown (glycogenolysis) / glycogen metabolic process / AMP binding ...purine nucleobase binding / vitamin binding / D-glucose binding / glycogen phosphorylase / glycogen phosphorylase activity / bile acid binding / glycogen catabolic process / Glycogen breakdown (glycogenolysis) / glycogen metabolic process / AMP binding / necroptotic process / response to bacterium / pyridoxal phosphate binding / glucose homeostasis / secretory granule lumen / ficolin-1-rich granule lumen / Neutrophil degranulation / extracellular exosome / extracellular region / ATP binding / identical protein binding / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.4 Å 分子置換 / 解像度: 2.4 Å | ||||||
 データ登録者 データ登録者 | Rath, V.L. / Ammirati, M. / LeMotte, P.K. / Fennell, K.F. / Mansour, M.N. / Danley, D.E. / Hynes, T.R. / Schulte, G.K. / Wasilko, D.J. / Pandit, J. | ||||||
 引用 引用 |  ジャーナル: Mol.Cell / 年: 2000 ジャーナル: Mol.Cell / 年: 2000タイトル: Activation of human liver glycogen phosphorylase by alteration of the secondary structure and packing of the catalytic core. 著者: Rath, V.L. / Ammirati, M. / LeMotte, P.K. / Fennell, K.F. / Mansour, M.N. / Danley, D.E. / Hynes, T.R. / Schulte, G.K. / Wasilko, D.J. / Pandit, J. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1fa9.cif.gz 1fa9.cif.gz | 187.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1fa9.ent.gz pdb1fa9.ent.gz | 146.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1fa9.json.gz 1fa9.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1fa9_validation.pdf.gz 1fa9_validation.pdf.gz | 836.3 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1fa9_full_validation.pdf.gz 1fa9_full_validation.pdf.gz | 865.7 KB | 表示 | |
| XML形式データ |  1fa9_validation.xml.gz 1fa9_validation.xml.gz | 36.6 KB | 表示 | |
| CIF形式データ |  1fa9_validation.cif.gz 1fa9_validation.cif.gz | 51.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/fa/1fa9 https://data.pdbj.org/pub/pdb/validation_reports/fa/1fa9 ftp://data.pdbj.org/pub/pdb/validation_reports/fa/1fa9 ftp://data.pdbj.org/pub/pdb/validation_reports/fa/1fa9 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 単位格子 |
| ||||||||
| 詳細 | The biological assembly is a dimer constructed from chain A a symmetry partner generated by the two-fold. |
- 要素
要素
| #1: タンパク質 | 分子量: 97225.250 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 組織: LIVER / プラスミド: PKK2332 / 発現宿主: Homo sapiens (ヒト) / 組織: LIVER / プラスミド: PKK2332 / 発現宿主:  |
|---|---|
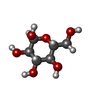
| #2: 糖 | ChemComp-GLC / |
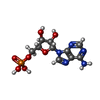
| #3: 化合物 | ChemComp-AMP / |
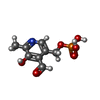
| #4: 化合物 | ChemComp-PLP / |
| #5: 水 | ChemComp-HOH / |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.91 Å3/Da / 溶媒含有率: 57.72 % | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | 温度: 298 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 8.5 詳細: Peg 8000, Tris/HCl, AMP, glucose, pH 8.5, VAPOR DIFFUSION, HANGING DROP, temperature 25K | ||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS pH: 6.8 | ||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU RU200 / 波長: 1.5418 回転陽極 / タイプ: RIGAKU RU200 / 波長: 1.5418 |
| 検出器 | タイプ: RIGAKU RAXIS IIC / 検出器: IMAGE PLATE / 日付: 1994年7月19日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 2.4→50 Å / Num. all: 44772 / Num. obs: 43732 / % possible obs: 98.5 % / Observed criterion σ(F): 0 / Observed criterion σ(I): -2 / 冗長度: 9 % / Biso Wilson estimate: 38.3 Å2 / Rmerge(I) obs: 0.057 / Net I/σ(I): 22.9 |
| 反射 シェル | 解像度: 2.4→2.49 Å / 冗長度: 2 % / Rmerge(I) obs: 0.495 / % possible all: 91.8 |
| 反射 | *PLUS Num. obs: 53400 |
| 反射 シェル | *PLUS % possible obs: 91.8 % |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 1GPA 解像度: 2.4→50 Å / 交差検証法: X-PLOR / σ(F): 0 / σ(I): 0 / 立体化学のターゲット値: Engh & Huber
| |||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.4→50 Å
| |||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.4→2.42 Å / Rfactor Rfree: 0.476 / Rfactor Rwork: 0.353 | |||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称:  X-PLOR / バージョン: 3.1 / 分類: refinement X-PLOR / バージョン: 3.1 / 分類: refinement | |||||||||||||||||||||||||
| 精密化 | *PLUS 最高解像度: 2.4 Å / 最低解像度: 50 Å / σ(F): 0 / % reflection Rfree: 10 % | |||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | |||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | |||||||||||||||||||||||||
| 拘束条件 | *PLUS
| |||||||||||||||||||||||||
| LS精密化 シェル | *PLUS 最高解像度: 2.4 Å / Rfactor Rfree: 0.476 / Rfactor Rwork: 0.353 / Rfactor obs: 0.353 |
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj