+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1cus | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | FUSARIUM SOLANI CUTINASE IS A LIPOLYTIC ENZYME WITH A CATALYTIC SERINE ACCESSIBLE TO SOLVENT | ||||||
 要素 要素 | CUTINASE | ||||||
 キーワード キーワード | HYDROLASE(SERINE ESTERASE) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | ||||||
| 生物種 |  Nectria haematococca mpVI (菌類) Nectria haematococca mpVI (菌類) | ||||||
| 手法 |  X線回折 / 解像度: 1.25 Å X線回折 / 解像度: 1.25 Å | ||||||
 データ登録者 データ登録者 | Martinez, C. / Cambillau, C. | ||||||
 引用 引用 |  ジャーナル: Nature / 年: 1992 ジャーナル: Nature / 年: 1992タイトル: Fusarium solani cutinase is a lipolytic enzyme with a catalytic serine accessible to solvent. 著者: Martinez, C. / De Geus, P. / Lauwereys, M. / Matthyssens, G. / Cambillau, C. #1:  ジャーナル: Biochemistry / 年: 1994 ジャーナル: Biochemistry / 年: 1994タイトル: Cutinase, a Lipolytic Enzyme with a Preformed Oxyanion Hole 著者: Martinez, C. / Nicolas, A. / Van Tilbeurgh, H. / Egloff, M.-P. / Cudrey, C. / Verger, R. / Cambillau, C. #2:  ジャーナル: Protein Eng. / 年: 1993 ジャーナル: Protein Eng. / 年: 1993タイトル: Engineering Cysteine Mutants to Obtain Crystallographic Phases with a Cutinase from Fusarium Solani Pisi 著者: Martinez, C. / De Geus, P. / Stanssens, P. / Lauwereys, M. / Cambillau, C. #3:  ジャーナル: J.Mol.Biol. / 年: 1990 ジャーナル: J.Mol.Biol. / 年: 1990タイトル: Crystallization and Preliminary X-Ray Study of a Recombinant Cutinase from Fusarium Solani Pisi 著者: Abergel, C. / Martinez, C. / Fontecilla-Camps, J. / Cambillau, C. / De Geus, P. / Lauwereys, M. | ||||||
| 履歴 |
|
- 構造の表示
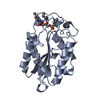
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1cus.cif.gz 1cus.cif.gz | 67.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1cus.ent.gz pdb1cus.ent.gz | 50.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1cus.json.gz 1cus.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1cus_validation.pdf.gz 1cus_validation.pdf.gz | 357.5 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1cus_full_validation.pdf.gz 1cus_full_validation.pdf.gz | 358.7 KB | 表示 | |
| XML形式データ |  1cus_validation.xml.gz 1cus_validation.xml.gz | 5.2 KB | 表示 | |
| CIF形式データ |  1cus_validation.cif.gz 1cus_validation.cif.gz | 8.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/cu/1cus https://data.pdbj.org/pub/pdb/validation_reports/cu/1cus ftp://data.pdbj.org/pub/pdb/validation_reports/cu/1cus ftp://data.pdbj.org/pub/pdb/validation_reports/cu/1cus | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 20742.285 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Nectria haematococca mpVI (菌類) / 生物種: Nectria haematococca / 株: mpVI Nectria haematococca mpVI (菌類) / 生物種: Nectria haematococca / 株: mpVI参照: UniProt: P00590, 加水分解酵素; エステル加水分解酵素; カルボン酸エステル加水分解酵素 |
|---|---|
| #2: 水 | ChemComp-HOH / |
| Has protein modification | Y |
| 配列の詳細 | SEQUENCE ADVISORY NOTICE: DIFFERENCE BETWEEN SWISS-PROT AND PDB SEQUENCE. SWISS-PROT ENTRY NAME: ...SEQUENCE ADVISORY NOTICE: DIFFERENCE |
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.11 Å3/Da / 溶媒含有率: 41.57 % | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | *PLUS 温度: 20 ℃ / 手法: 蒸気拡散法, ハンギングドロップ法詳細: used to seed, referred to J.Mol.Biol. 215.215-216 1990 PH range low: 8 / PH range high: 7 | ||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射 | 散乱光タイプ: x-ray |
|---|---|
| 放射波長 | 相対比: 1 |
| 反射 | *PLUS 最高解像度: 1.25 Å / Num. obs: 39563 / Num. measured all: 114297 / Rmerge(I) obs: 0.061 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 1.25→6 Å / Rfactor Rwork: 0.158 / Rfactor obs: 0.158 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.25→6 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称:  X-PLOR / 分類: refinement X-PLOR / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS Rfactor obs: 0.158 / Rfactor Rwork: 0.158 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS タイプ: x_angle_d / Dev ideal: 2.08 |
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj

