+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1cjt | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | COMPLEX OF GS-ALPHA WITH THE CATALYTIC DOMAINS OF MAMMALIAN ADENYLYL CYCLASE: COMPLEX WITH BETA-L-2',3'-DIDEOXYATP, MN, AND MG | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | LYASE/LYASE/SIGNALING PROTEIN / COMPLEX (LYASE-HYDROLASE) / HYDROLASE / SIGNAL TRANSDUCING PROTEIN / CYCLASE / EFFECTOR ENZYME / LYASE-LYASE-SIGNALING PROTEIN COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Adenylate cyclase activating pathway / Hedgehog 'off' state / PKA activation / Adenylate cyclase inhibitory pathway / sensory perception of chemical stimulus / adenylate cyclase / regulation of insulin secretion involved in cellular response to glucose stimulus / mu-type opioid receptor binding / corticotropin-releasing hormone receptor 1 binding / cAMP biosynthetic process ...Adenylate cyclase activating pathway / Hedgehog 'off' state / PKA activation / Adenylate cyclase inhibitory pathway / sensory perception of chemical stimulus / adenylate cyclase / regulation of insulin secretion involved in cellular response to glucose stimulus / mu-type opioid receptor binding / corticotropin-releasing hormone receptor 1 binding / cAMP biosynthetic process / G alpha (z) signalling events / adenylate cyclase activity / beta-2 adrenergic receptor binding / adenylate cyclase binding / D1 dopamine receptor binding / adenylate cyclase-activating adrenergic receptor signaling pathway / insulin-like growth factor receptor binding / ionotropic glutamate receptor binding / cellular response to forskolin / adenylate cyclase activator activity / adenylate cyclase-modulating G protein-coupled receptor signaling pathway / G-protein beta/gamma-subunit complex binding / adenylate cyclase-activating G protein-coupled receptor signaling pathway / adenylate cyclase-activating dopamine receptor signaling pathway / heterotrimeric G-protein complex / manganese ion binding / positive regulation of cytosolic calcium ion concentration / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / intracellular signal transduction / cilium / membrane raft / GTPase activity / dendrite / GTP binding / magnesium ion binding / protein-containing complex / ATP binding / metal ion binding / membrane / plasma membrane / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |    | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.8 Å 分子置換 / 解像度: 2.8 Å | ||||||
 データ登録者 データ登録者 | Tesmer, J.J.G. / Sprang, S.R. | ||||||
 引用 引用 |  ジャーナル: Science / 年: 1999 ジャーナル: Science / 年: 1999タイトル: Two-metal-Ion catalysis in adenylyl cyclase. 著者: Tesmer, J.J. / Sunahara, R.K. / Johnson, R.A. / Gosselin, G. / Gilman, A.G. / Sprang, S.R. #1:  ジャーナル: Science / 年: 1997 ジャーナル: Science / 年: 1997タイトル: Crystal Structure of the Catalytic Domains of Adenylyl Cyclase in a Complex with Gsalpha(Dot)Gtpgammas 著者: Tesmer, J.J. / Sunahara, R.K. / Gilman, A.G. / Sprang, S.R. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1cjt.cif.gz 1cjt.cif.gz | 158.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1cjt.ent.gz pdb1cjt.ent.gz | 124.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1cjt.json.gz 1cjt.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1cjt_validation.pdf.gz 1cjt_validation.pdf.gz | 1.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1cjt_full_validation.pdf.gz 1cjt_full_validation.pdf.gz | 1.3 MB | 表示 | |
| XML形式データ |  1cjt_validation.xml.gz 1cjt_validation.xml.gz | 27.7 KB | 表示 | |
| CIF形式データ |  1cjt_validation.cif.gz 1cjt_validation.cif.gz | 37.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/cj/1cjt https://data.pdbj.org/pub/pdb/validation_reports/cj/1cjt ftp://data.pdbj.org/pub/pdb/validation_reports/cj/1cjt ftp://data.pdbj.org/pub/pdb/validation_reports/cj/1cjt | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||||
| 単位格子 |
|
- 要素
要素
-ADENYLATE CYCLASE, TYPE ... , 2種, 2分子 AB
| #1: タンパク質 | 分子量: 24495.361 Da / 分子数: 1 / 断片: C1A DOMAIN OF ADENYLYL CYCLASE / 変異: V476M / 由来タイプ: 組換発現 / 由来: (組換発現)   |
|---|---|
| #2: タンパク質 | 分子量: 23717.033 Da / 分子数: 1 / 断片: C2A DOMAIN OF ADENYLYL CYCLASE / 由来タイプ: 組換発現 / 由来: (組換発現)   |
-タンパク質 , 1種, 1分子 C
| #3: タンパク質 | 分子量: 46656.438 Da / 分子数: 1 / 断片: TRYPSINIZED FRAGMENT / 変異: N-TERMINAL HEXAHISTIDINE TAG / 由来タイプ: 組換発現 / 由来: (組換発現)   |
|---|
-非ポリマー , 8種, 74分子 


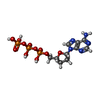


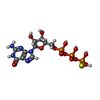








| #4: 化合物 | | #5: 化合物 | ChemComp-MN / | #6: 化合物 | ChemComp-FOK / | #7: 化合物 | ChemComp-DAD / | #8: 化合物 | ChemComp-MES / | #9: 化合物 | ChemComp-CL / | #10: 化合物 | ChemComp-GSP / | #11: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3 Å3/Da / 溶媒含有率: 58 % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 5.6 詳細: CRYSTALLIZED IN HANGING DROPS CONTAINING PROTEIN MIXED 1:1 WITH WELL SOLUTION OF 7.2-7.5% PEG 8000, 500MM NACL AND 100 MM PHOSPHATE BUFFER (PH 5.4-5.6), VAPOR DIFFUSION, HANGING DROP | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 手法: 蒸気拡散法 / 詳細: Tesmer, J.J., (1997) Science, 278, 1907. / PH range low: 5.6 / PH range high: 5.4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  CHESS CHESS  / ビームライン: F2 / 波長: 0.923 / ビームライン: F2 / 波長: 0.923 |
| 検出器 | タイプ: ADSC QUANTUM 4 / 検出器: CCD / 日付: 1998年8月15日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.923 Å / 相対比: 1 |
| 反射 | 解像度: 2.8→40 Å / Num. obs: 37320 / % possible obs: 98.8 % / Observed criterion σ(I): -3 / 冗長度: 3.4 % / Biso Wilson estimate: 33.7 Å2 / Rsym value: 0.106 / Net I/σ(I): 11.5 |
| 反射 シェル | 解像度: 2.8→2.95 Å / 冗長度: 3.4 % / Mean I/σ(I) obs: 2.5 / Rsym value: 0.394 / % possible all: 100 |
| 反射 | *PLUS Rmerge(I) obs: 0.106 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1AZS 解像度: 2.8→15 Å / Rfactor Rfree error: 0.005 / Data cutoff high rms absF: 1744485.68 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 0 詳細: A BULK SOLVENT CORRECTION WAS USED. REFLECTIONS WITH L>21 WERE OMITTED FROM REFINEMENT
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: FLAT MODEL / Bsol: 10 Å2 / ksol: 0.3107 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 41.3 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.8→15 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.8→2.9 Å / Rfactor Rfree error: 0.023 / Total num. of bins used: 10
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: CNS / バージョン: 0.5 / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS σ(F): 0 / % reflection Rfree: 9.9 % / Rfactor obs: 0.206 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS Biso mean: 41.3 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | *PLUS Rfactor Rfree: 0.349 / % reflection Rfree: 9.6 % / Rfactor Rwork: 0.307 |
 ムービー
ムービー コントローラー
コントローラー




















 PDBj
PDBj
















