+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6120 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of a mycobacterial protein | |||||||||
 マップデータ マップデータ | Reconstruction of mycobacterial protein | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報protein secretion by the type VII secretion system / symbiont-mediated suppression of host autophagy / biological process involved in interaction with host / extracellular region / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 30.0 Å | |||||||||
 データ登録者 データ登録者 | Solomonson M / Setiaputra D / Makepeace KAT / Lameignere E / Petrotchenko EV / Conrady DG / Bergeron JR / Vuckovic M / DiMaio F / Borchers CH ...Solomonson M / Setiaputra D / Makepeace KAT / Lameignere E / Petrotchenko EV / Conrady DG / Bergeron JR / Vuckovic M / DiMaio F / Borchers CH / Yip CK / Strynadka NCJ | |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2015 ジャーナル: Structure / 年: 2015タイトル: Structure of EspB from the ESX-1 type VII secretion system and insights into its export mechanism. 著者: Matthew Solomonson / Dheva Setiaputra / Karl A T Makepeace / Emilie Lameignere / Evgeniy V Petrotchenko / Deborah G Conrady / Julien R Bergeron / Marija Vuckovic / Frank DiMaio / Christoph H ...著者: Matthew Solomonson / Dheva Setiaputra / Karl A T Makepeace / Emilie Lameignere / Evgeniy V Petrotchenko / Deborah G Conrady / Julien R Bergeron / Marija Vuckovic / Frank DiMaio / Christoph H Borchers / Calvin K Yip / Natalie C J Strynadka /   要旨: Mycobacterium tuberculosis (Mtb) uses the ESX-1 type VII secretion system to export virulence proteins across its lipid-rich cell wall, which helps permeabilize the host's macrophage phagosomal ...Mycobacterium tuberculosis (Mtb) uses the ESX-1 type VII secretion system to export virulence proteins across its lipid-rich cell wall, which helps permeabilize the host's macrophage phagosomal membrane, facilitating the escape and cell-to-cell spread of Mtb. ESX-1 membranolytic activity depends on a set of specialized secreted Esp proteins, the structure and specific roles of which are not currently understood. Here, we report the X-ray and electron microscopic structures of the ESX-1-secreted EspB. We demonstrate that EspB adopts a PE/PPE-like fold that mediates oligomerization with apparent heptameric symmetry, generating a barrel-shaped structure with a central pore that we propose contributes to the macrophage killing functions of EspB. Our structural data also reveal unexpected direct interactions between the EspB bipartite secretion signal sequence elements that form a unified aromatic surface. These findings provide insight into how specialized proteins encoded within the ESX-1 locus are targeted for secretion, and for the first time indicate an oligomerization-dependent role for Esp virulence factors. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6120.map.gz emd_6120.map.gz | 954 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6120-v30.xml emd-6120-v30.xml emd-6120.xml emd-6120.xml | 11.2 KB 11.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  400_6120.gif 400_6120.gif 80_6120.gif 80_6120.gif | 29 KB 3.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6120 http://ftp.pdbj.org/pub/emdb/structures/EMD-6120 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6120 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6120 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_6120_validation.pdf.gz emd_6120_validation.pdf.gz | 298.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_6120_full_validation.pdf.gz emd_6120_full_validation.pdf.gz | 298.3 KB | 表示 | |
| XML形式データ |  emd_6120_validation.xml.gz emd_6120_validation.xml.gz | 4.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6120 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6120 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6120 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6120 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6120.map.gz / 形式: CCP4 / 大きさ: 1001 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6120.map.gz / 形式: CCP4 / 大きさ: 1001 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Reconstruction of mycobacterial protein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 4.7 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
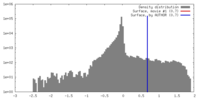
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Mycobacterial protein
| 全体 | 名称: Mycobacterial protein |
|---|---|
| 要素 |
|
-超分子 #1000: Mycobacterial protein
| 超分子 | 名称: Mycobacterial protein / タイプ: sample / ID: 1000 / Number unique components: 1 |
|---|---|
| 分子量 | 実験値: 230 KDa / 理論値: 230 KDa 手法: size exclusion chromatography coupled to multi-angle light scattering |
-分子 #1: Mycobacterial protein
| 分子 | 名称: Mycobacterial protein / タイプ: protein_or_peptide / ID: 1 / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.01 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 / 詳細: 20 mM HEPES, 150 mM NaCl |
| 染色 | タイプ: NEGATIVE 詳細: Protein was adsorbed onto grid, quickly blotted, and floated on 1% uranyl formate solution for 30 seconds |
| グリッド | 詳細: 200 mesh gold grid with thin carbon support, glow discharged |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI SPIRIT |
|---|---|
| 温度 | 平均: 298 K |
| 詳細 | Low dose |
| 日付 | 2013年8月28日 |
| 撮影 | カテゴリ: CCD / フィルム・検出器のモデル: FEI EAGLE (4k x 4k) / デジタル化 - サンプリング間隔: 1.3 µm / 実像数: 50 / 平均電子線量: 25 e/Å2 / ビット/ピクセル: 16 |
| 電子線 | 加速電圧: 120 kV / 電子線源: LAB6 |
| 電子光学系 | 倍率(補正後): 65900 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.2 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 49000 |
| 試料ステージ | 試料ホルダー: side entry room temperature tomography holder 試料ホルダーモデル: SIDE ENTRY, EUCENTRIC |
| 実験機器 |  モデル: Tecnai Spirit / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 30.0 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: Spider, EMAN2 詳細: Initial reconstructions were determined from a side-view 2D average based on observed 7-fold symmetry of the top view using a rotational extrusion method. The initial model was then refined ...詳細: Initial reconstructions were determined from a side-view 2D average based on observed 7-fold symmetry of the top view using a rotational extrusion method. The initial model was then refined in 6 iterations with EMAN2 using untilted particles. 使用した粒子像数: 1455 |
|---|---|
| 最終 2次元分類 | クラス数: 2 |
 ムービー
ムービー コントローラー
コントローラー



 UCSF Chimera
UCSF Chimera








 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)