+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Chloroflexus aurantiacus ATP synthase, state 3, focused refinement of FO and peripheral stalk | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ATP synthesis / proton channels / proton-motive force / proton translocation / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報proton motive force-driven plasma membrane ATP synthesis / proton motive force-driven ATP synthesis / proton-transporting two-sector ATPase complex, proton-transporting domain / proton-transporting ATP synthase complex / proton-transporting ATP synthase activity, rotational mechanism / lipid binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |   Chloroflexus aurantiacus J-10-fl (バクテリア) Chloroflexus aurantiacus J-10-fl (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.6 Å | |||||||||
 データ登録者 データ登録者 | Zhang X / Wu J / Xu X | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2025 ジャーナル: Proc Natl Acad Sci U S A / 年: 2025タイトル: Structure of ATP synthase from an early photosynthetic bacterium . 著者: Xin Zhang / Jingyi Wu / Zhenzhen Min / Jiamao Wang / Xin Hong / Xinkai Pei / Zihe Rao / Xiaoling Xu /  要旨: F-type ATP synthase (FF) catalyzes proton motive force-driven ATP synthesis in mitochondria, chloroplasts, and bacteria. Different from the mitochondrial and bacterial enzymes, FF from photosynthetic ...F-type ATP synthase (FF) catalyzes proton motive force-driven ATP synthesis in mitochondria, chloroplasts, and bacteria. Different from the mitochondrial and bacterial enzymes, FF from photosynthetic organisms have evolved diverse structural and mechanistic details to adapt to the light-dependent reactions. Although complete structure of chloroplast FF has been reported, no high-resolution structure of an FF from photosynthetic bacteria has been available. Here, we report cryo-EM structures of an intact and functionally competent FF from (FF), a filamentous anoxygenic phototrophic bacterium from the earliest branch of photosynthetic organisms. The structures of FF in its ADP-free and ADP-bound forms for three rotational states reveal a previously unrecognized architecture of ATP synthases. A pair of peripheral stalks connect to the F head through a dimer of δ-subunits, and associate with two membrane-embedded a-subunits that are asymmetrically positioned outside and clamp F's c-ring. The two a-subunits constitute two proton inlets on the periplasmic side and two proton outlets on the cytoplasmic side, endowing FF with unique proton translocation pathways that allow more protons being translocated relative to single a-subunit FF. Our findings deepen understanding of the architecture and proton translocation mechanisms of FF synthases and suggest innovative strategies for modulating their activities by altering the number of a-subunit. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_60876.map.gz emd_60876.map.gz | 121 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-60876-v30.xml emd-60876-v30.xml emd-60876.xml emd-60876.xml | 18.1 KB 18.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_60876_fsc.xml emd_60876_fsc.xml | 13.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_60876.png emd_60876.png | 38.1 KB | ||
| Filedesc metadata |  emd-60876.cif.gz emd-60876.cif.gz | 5.6 KB | ||
| その他 |  emd_60876_half_map_1.map.gz emd_60876_half_map_1.map.gz emd_60876_half_map_2.map.gz emd_60876_half_map_2.map.gz | 226.8 MB 226.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-60876 http://ftp.pdbj.org/pub/emdb/structures/EMD-60876 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-60876 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-60876 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9itrMC  9itjC  9itkC  9itlC  9itmC  9itnC  9itoC  9itpC  9itqC  9itsC  9ittC  9ituC  9itvC  9itwC  9itxC  9ityC  9itzC  9iu0C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_60876.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_60876.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.93 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_60876_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
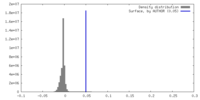
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_60876_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
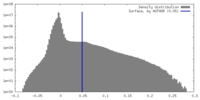
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : ATP synthase
| 全体 | 名称: ATP synthase |
|---|---|
| 要素 |
|
-超分子 #1: ATP synthase
| 超分子 | 名称: ATP synthase / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Chloroflexus aurantiacus J-10-fl (バクテリア) Chloroflexus aurantiacus J-10-fl (バクテリア) |
-分子 #1: ATP synthase subunit c
| 分子 | 名称: ATP synthase subunit c / タイプ: protein_or_peptide / ID: 1 / コピー数: 10 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Chloroflexus aurantiacus J-10-fl (バクテリア) Chloroflexus aurantiacus J-10-fl (バクテリア) |
| 分子量 | 理論値: 7.688102 KDa |
| 配列 | 文字列: MEGLNLVATA LAVGLGAIGP GVGIGIIVSG AVQAIGRNPE IENRVVTYMF IGIAFTEALA IFGLVIAFLI GFGVLQ UniProtKB: ATP synthase subunit c |
-分子 #2: ATP synthase subunit a
| 分子 | 名称: ATP synthase subunit a / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Chloroflexus aurantiacus J-10-fl (バクテリア) Chloroflexus aurantiacus J-10-fl (バクテリア) |
| 分子量 | 理論値: 34.176105 KDa |
| 配列 | 文字列: MSTRTRNILI IVGALIISIA SRFFLYTGPP HVEVAAEVIF DGIPGFPITN SFVVAIIIDI FVIALAVAAT RNLQMVPRGL QNVMEFILE SLYNLFRNIN AKYVATAFPL VATIFLFVLF GNWFGLLPGV GSIGVCHEKK EEHAVVDERL ALAAPAAPLS S VAAAEGEE ...文字列: MSTRTRNILI IVGALIISIA SRFFLYTGPP HVEVAAEVIF DGIPGFPITN SFVVAIIIDI FVIALAVAAT RNLQMVPRGL QNVMEFILE SLYNLFRNIN AKYVATAFPL VATIFLFVLF GNWFGLLPGV GSIGVCHEKK EEHAVVDERL ALAAPAAPLS S VAAAEGEE IHDTCAAQGK KLVPLFRAPA ADLNFTFAIA VISFVFIEYW GFRALGPGYL KKFFNTNGIM SFVGIIEFIS EL VKPFALA FRLFGNIFAG EVLLVVMAFL VPLLLPLPFY GFEVFVGFIQ ALIFALLTYA FLNIAVTGHD EEHAH UniProtKB: ATP synthase subunit a |
-分子 #3: ATP synthase subunit b
| 分子 | 名称: ATP synthase subunit b / タイプ: protein_or_peptide / ID: 3 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Chloroflexus aurantiacus J-10-fl (バクテリア) Chloroflexus aurantiacus J-10-fl (バクテリア) |
| 分子量 | 理論値: 18.710455 KDa |
| 配列 | 文字列: MEALGINPTL FIAQLINFLL LIFILRALLY RPVMNLLNER TRRIEESVRD AEKVREQLAN ARRDYEAEIA RARQEAAKIV AQAQERAKQ QEAEIIAQAR REAERLKEEA RAQAEQERIR MLSEAKSQIA DLVTLTASRV LGAELQARGH DALIAESLAA L DRRN UniProtKB: ATP synthase subunit b |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.6 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)