+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-5763 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Electron cryo-microscopy of two-stranded TubZ filament from B. thuringiensis | |||||||||
 マップデータ マップデータ | Helical Reconstruction of two-stranded TubZ-Bt bound to GTPgammaS | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | plasmid segregation / tubulin family / bacterial cytoskeleton | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報plasmid partitioning / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / GTPase activity / GTP binding / metal ion binding / identical protein binding / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
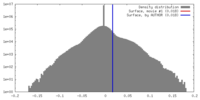
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 10.8 Å | |||||||||
 データ登録者 データ登録者 | Montabana EA / Agard DA | |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2014 ジャーナル: Proc Natl Acad Sci U S A / 年: 2014タイトル: Bacterial tubulin TubZ-Bt transitions between a two-stranded intermediate and a four-stranded filament upon GTP hydrolysis. 著者: Elizabeth A Montabana / David A Agard /  要旨: Cytoskeletal filaments form diverse superstructures that are highly adapted for specific functions. The recently discovered TubZ subfamily of tubulins is involved in type III plasmid partitioning ...Cytoskeletal filaments form diverse superstructures that are highly adapted for specific functions. The recently discovered TubZ subfamily of tubulins is involved in type III plasmid partitioning systems, facilitating faithful segregation of low copy-number plasmids during bacterial cell division. One such protein, TubZ-Bt, is found on the large pBtoxis plasmid in Bacillus thuringiensis, and interacts via its extended C terminus with a DNA adaptor protein TubR. Here, we use cryo-electron microscopy to determine the structure of TubZ-Bt filaments and light scattering to explore their mechanism of polymerization. Surprisingly, we find that the helical filament architecture is remarkably sensitive to nucleotide state, changing from two-stranded to four-stranded depending on the ability of TubZ-Bt to hydrolyze GTP. We present pseudoatomic models of both the two- and four-protofilament forms based on cryo-electron microscopy reconstructions (10.8 Å and 6.9 Å, respectively) of filaments formed under different nucleotide states. These data lead to a model in which the two-stranded filament is a necessary intermediate along the pathway to formation of the four-stranded filament. Such nucleotide-directed structural polymorphism is to our knowledge an unprecedented mechanism for the formation of polar filaments. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_5763.map.gz emd_5763.map.gz | 10.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-5763-v30.xml emd-5763-v30.xml emd-5763.xml emd-5763.xml | 10.8 KB 10.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_5763.jpg emd_5763.jpg | 37 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-5763 http://ftp.pdbj.org/pub/emdb/structures/EMD-5763 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5763 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5763 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_5763_validation.pdf.gz emd_5763_validation.pdf.gz | 349.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_5763_full_validation.pdf.gz emd_5763_full_validation.pdf.gz | 348.8 KB | 表示 | |
| XML形式データ |  emd_5763_validation.xml.gz emd_5763_validation.xml.gz | 5.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5763 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5763 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5763 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5763 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_5763.map.gz / 形式: CCP4 / 大きさ: 39.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_5763.map.gz / 形式: CCP4 / 大きさ: 39.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Helical Reconstruction of two-stranded TubZ-Bt bound to GTPgammaS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.203 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : N-terminally tagged full length TubZ from pBtoxis in Bacillus thu...
| 全体 | 名称: N-terminally tagged full length TubZ from pBtoxis in Bacillus thuringiensis |
|---|---|
| 要素 |
|
-超分子 #1000: N-terminally tagged full length TubZ from pBtoxis in Bacillus thu...
| 超分子 | 名称: N-terminally tagged full length TubZ from pBtoxis in Bacillus thuringiensis タイプ: sample / ID: 1000 集合状態: Helical filament with two protofilament strands Number unique components: 1 |
|---|
-分子 #1: ftsZ/tubulin-related protein
| 分子 | 名称: ftsZ/tubulin-related protein / タイプ: protein_or_peptide / ID: 1 / Name.synonym: TubZ-Bt, TubZ / 集合状態: helical two-stranded filament / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 実験値: 54.3729 KDa |
| 組換発現 | 生物種:  |
| 配列 | UniProtKB: Tubulin-like protein TubZ / InterPro: Tubulin/FtsZ, GTPase domain |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.7 詳細: 100 mM potassium acetate, 5 mM magnesium acetate, 50 mM HEPES |
|---|---|
| グリッド | 詳細: 400 mesh copper grid with holey carbon support, glow discharged |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / 装置: FEI VITROBOT MARK III Timed resolved state: TubZ was preheated at 37 degrees and polymerization was initiated with saturating GTPgammaS. TubZ was then incubated for 30 seconds at room temperature before sample application and plunge-freezing. 手法: Blot 4.5 seconds before plunging. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| アライメント法 | Legacy - 非点収差: Astigmatism corrected at 250,000 times magnification |
| 日付 | 2010年5月26日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: TVIPS TEMCAM-F816 (8k x 8k) 実像数: 348 / 平均電子線量: 20 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.2 mm / 最大 デフォーカス(公称値): 4.5 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 62000 |
| 試料ステージ | 試料ホルダーモデル: OTHER |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
- 画像解析
画像解析
| 詳細 | The particles were aligned using IHRSR. The azimuthal angle refined to 191.84151 degrees and the rise to 22.04811 Angstroms with a right-handed helix. |
|---|---|
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 22.04811 Å 想定した対称性 - らせんパラメータ - ΔΦ: 168.15849 ° アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 10.8 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: Spider 詳細: Final map has been low-pass filtered to 11 Angstrom and high-pass filtered to 35 Angstrom. A B-factor of -452 Angstroms was applied using the program bfactor. A cylindrical mask of radius ~78 ...詳細: Final map has been low-pass filtered to 11 Angstrom and high-pass filtered to 35 Angstrom. A B-factor of -452 Angstroms was applied using the program bfactor. A cylindrical mask of radius ~78 Angstrom has been applied. |
| CTF補正 | 詳細: Whole micrograph |
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)