+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of acylaminoacyl peptidase (AAP) in covalent complex with inhibitor AEBSF | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | inhibitor / covalent / serine-protease / acylpeptide hydrolase / APEH / OPH / acylaminoacyl peptidase / sulphonate / HYDROLASE | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報acylaminoacyl-peptidase / omega peptidase activity / serine-type endopeptidase activity / proteolysis / cytoplasm 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.8 Å | ||||||||||||
 データ登録者 データ登録者 | Kiss-Szeman AJ / Menyhard DK / Harmat V / Perczel A | ||||||||||||
| 資金援助 |  ハンガリー, European Union, 3件 ハンガリー, European Union, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Protein Sci / 年: 2025 ジャーナル: Protein Sci / 年: 2025タイトル: Ligand binding Pro-miscuity of acylpeptide hydrolase, structural analysis of a detoxifying serine hydrolase. 著者: Anna J Kiss-Szemán / Luca Takács / Imre Jákli / Zoltán Bánóczi / Naoki Hosogi / Daouda A K Traore / Veronika Harmat / András Perczel / Dóra K Menyhárd /    要旨: Acylpeptide hydrolase (APEH) or acylaminoacyl-peptidase (AAP) is a serine hydrolase that regulates protein metabolism. It can also bind to and process unusual substrates, acting as a detoxifier. To ...Acylpeptide hydrolase (APEH) or acylaminoacyl-peptidase (AAP) is a serine hydrolase that regulates protein metabolism. It can also bind to and process unusual substrates, acting as a detoxifier. To better understand its promiscuous specificity, we determined the cryo-EM structures of mammalian APEH complexed with classical serine protease partners: a chloromethyl-ketone (CMK) inhibitor, an organophosphate (OP) pesticide (dichlorvos), and benzenesulfonyl-fluoride. Since CMK derivatives of N-acetylated peptides were suggested to induce apoptosis by inhibiting APEH, while OP complexes may serve as biomarkers of OP exposure and are linked to cognitive enhancement, these complexes carry physiological significance. We identified a unique strand-breaker Pro residue in the hydrolase domain, which relaxes the active site into a partially inactivated but more spacious conformation, transforming the classical serine protease apparatus into a versatile yet potent hydrolysis center with broad specificity, distinguishing the mammalian enzyme not only from other APEHs but also from serine α/β hydrolases sharing essentially the same fold. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_52489.map.gz emd_52489.map.gz | 207.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-52489-v30.xml emd-52489-v30.xml emd-52489.xml emd-52489.xml | 19.3 KB 19.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_52489_fsc.xml emd_52489_fsc.xml | 12.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_52489.png emd_52489.png | 69.9 KB | ||
| Filedesc metadata |  emd-52489.cif.gz emd-52489.cif.gz | 6.3 KB | ||
| その他 |  emd_52489_half_map_1.map.gz emd_52489_half_map_1.map.gz emd_52489_half_map_2.map.gz emd_52489_half_map_2.map.gz | 225.9 MB 225.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-52489 http://ftp.pdbj.org/pub/emdb/structures/EMD-52489 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-52489 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-52489 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_52489_validation.pdf.gz emd_52489_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_52489_full_validation.pdf.gz emd_52489_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_52489_validation.xml.gz emd_52489_validation.xml.gz | 19.6 KB | 表示 | |
| CIF形式データ |  emd_52489_validation.cif.gz emd_52489_validation.cif.gz | 25.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52489 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52489 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52489 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52489 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_52489.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_52489.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.75 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_52489_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_52489_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Tetrameric structure of acylaminoacyl-peptidase (AAP) in covalent...
| 全体 | 名称: Tetrameric structure of acylaminoacyl-peptidase (AAP) in covalent complex with AES hydrolysed from AEBSF |
|---|---|
| 要素 |
|
-超分子 #1: Tetrameric structure of acylaminoacyl-peptidase (AAP) in covalent...
| 超分子 | 名称: Tetrameric structure of acylaminoacyl-peptidase (AAP) in covalent complex with AES hydrolysed from AEBSF タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Acylamino-acid-releasing enzyme
| 分子 | 名称: Acylamino-acid-releasing enzyme / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO / EC番号: acylaminoacyl-peptidase |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 81.324391 KDa |
| 配列 | 文字列: MERQVLLSEP EEAAALYRGL SRQPALSAAC LGPEVTTQYG GRYRTVHTEW TQRDLERMEN IRFCRQYLVF HDGDSVVFAG PAGNSVETR GELLSRESPS GTMKAVLRKA GGTGTAEEKQ FLEVWEKNRK LKSFNLSALE KHGPVYEDDC FGCLSWSHSE T HLLYVADK ...文字列: MERQVLLSEP EEAAALYRGL SRQPALSAAC LGPEVTTQYG GRYRTVHTEW TQRDLERMEN IRFCRQYLVF HDGDSVVFAG PAGNSVETR GELLSRESPS GTMKAVLRKA GGTGTAEEKQ FLEVWEKNRK LKSFNLSALE KHGPVYEDDC FGCLSWSHSE T HLLYVADK KRPKAESFFQ TKALDVTGSD DEMARTKKPD QAIKGDQFLF YEDWGENMVS KSTPVLCVLD IESGNISVLE GV PESVSPG QAFWAPGDTG VVFVGWWHEP FRLGIRFCTN RRSALYYVDL TGGKCELLSD ESVAVTSPRL SPDQCRIVYL RFP SLVPHQ QCGQLCLYDW YTRVTSVVVD IVPRQLGEDF SGIYCSLLPL GCWSADSQRV VFDSPQRSRQ DLFAVDTQMG SVTS LTAGG SGGSWKLLTI DRDLMVVQFS TPSVPPSLKV GFLPPAGKEQ AVSWVSLEEA EPFPDISWSI RVLQPPPQQE HVQYA GLDF EAILLQPSNS PEKTQVPMVV MPHGGPHSSF VTAWMLFPAM LCKMGFAVLL VNYRGSTGFG QDSILSLPGN VGHQDV KDV QFAVEQVLQE EHFDAGRVAL MGGSHGGFLS CHLIGQYPET YSACVVRNPV INIASMMGST DIPDWCMVEA GFSYSSD CL PDLSVWAAML DKSPIKYAPQ VKTPLLLMLG QEDRRVPFKQ GMEYYRVLKA RNVPVRLLLY PKSTHALSEV EVESDSFM N AVLWLCTHLG S UniProtKB: Acylamino-acid-releasing enzyme |
-分子 #2: 4-(2-AMINOETHYL)BENZENESULFONYL FLUORIDE
| 分子 | 名称: 4-(2-AMINOETHYL)BENZENESULFONYL FLUORIDE / タイプ: ligand / ID: 2 / コピー数: 4 / 式: AES |
|---|---|
| 分子量 | 理論値: 203.234 Da |
| Chemical component information | 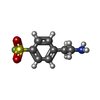 ChemComp-AES: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 / 構成要素 - 濃度: 10.0 mM / 構成要素 - 式: TRIS / 構成要素 - 名称: TRIS |
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - スリット幅: 10 eV |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 撮影したグリッド数: 1 / 平均電子線量: 12.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: OTHER / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 165000 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






































