+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4804 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM informed directed evolution of Nitrilase 4 leads to a change in quaternary structure. | |||||||||
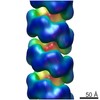
 マップデータ マップデータ | AtNIT4 R95T nitrilase filament | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  | |||||||||
| 手法 | らせん対称体再構成法 / ネガティブ染色法 / 解像度: 20.0 Å | |||||||||
 データ登録者 データ登録者 | Mulelu AE / Woodward JD | |||||||||
| 資金援助 |  南アフリカ, 1件 南アフリカ, 1件
| |||||||||
 引用 引用 |  ジャーナル: Commun Biol / 年: 2019 ジャーナル: Commun Biol / 年: 2019タイトル: Cryo-EM and directed evolution reveal how nitrilase specificity is influenced by its quaternary structure. 著者: Andani E Mulelu / Angela M Kirykowicz / Jeremy D Woodward /  要旨: Nitrilases are helical enzymes that convert nitriles to acids and/or amides. All plants have a nitrilase 4 homolog specific for ß-cyanoalanine, while in some plants neofunctionalization has produced ...Nitrilases are helical enzymes that convert nitriles to acids and/or amides. All plants have a nitrilase 4 homolog specific for ß-cyanoalanine, while in some plants neofunctionalization has produced nitrilases with altered specificity. Plant nitrilase substrate size and specificity correlate with helical twist, but molecular details of this relationship are lacking. Here we determine, to our knowledge, the first close-to-atomic resolution (3.4 Å) cryo-EM structure of an active helical nitrilase, the nitrilase 4 from . We apply site-saturation mutagenesis directed evolution to three residues (R95, S224, and L169) and generate a mutant with an altered helical twist that accepts substrates not catalyzed by known plant nitrilases. We reveal that a loop between α2 and α3 limits the length of the binding pocket and propose that it shifts position as a function of helical twist. These insights will allow us to start designing nitrilases for chemoenzymatic synthesis. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4804.map.gz emd_4804.map.gz | 334.3 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4804-v30.xml emd-4804-v30.xml emd-4804.xml emd-4804.xml | 12.9 KB 12.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_4804.png emd_4804.png | 98.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4804 http://ftp.pdbj.org/pub/emdb/structures/EMD-4804 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4804 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4804 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_4804_validation.pdf.gz emd_4804_validation.pdf.gz | 213.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_4804_full_validation.pdf.gz emd_4804_full_validation.pdf.gz | 212.9 KB | 表示 | |
| XML形式データ |  emd_4804_validation.xml.gz emd_4804_validation.xml.gz | 5.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4804 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4804 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4804 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4804 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4804.map.gz / 形式: CCP4 / 大きさ: 1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4804.map.gz / 形式: CCP4 / 大きさ: 1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | AtNIT4 R95T nitrilase filament | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 4.22 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Arabidopsis thaliana NITRILASE 4 filament
| 全体 | 名称: Arabidopsis thaliana NITRILASE 4 filament |
|---|---|
| 要素 |
|
-超分子 #1: Arabidopsis thaliana NITRILASE 4 filament
| 超分子 | 名称: Arabidopsis thaliana NITRILASE 4 filament / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Wild-type Arabidopsis thaliana NIT4 modified by site directed mutagenesis at position 95. |
|---|---|
| 由来(天然) | 生物種:  |
| 組換発現 | 生物種:  |
| 分子量 | 理論値: 49 kDa/nm |
-分子 #1: Arabidopsis thaliana Nitrilase 4 R95T
| 分子 | 名称: Arabidopsis thaliana Nitrilase 4 R95T / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO / EC番号: nitrilase |
|---|---|
| 由来(天然) | 生物種:  |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSMQQETSHM TAAPQTNGHQ IFPEIDMSAG DSSSIVRATV VQASTVFYDT PATLDKAERL LSEAAENGSQ LVVFPEAFIG GYPRGSTFEL AIGSTTAKGR DDFRKYHASA IDVPGPEVER LALMAKKYKV YLVMGVIERE GYTLYCTVLF FDSQGLFLGK HRKLMPTALE ...文字列: MSMQQETSHM TAAPQTNGHQ IFPEIDMSAG DSSSIVRATV VQASTVFYDT PATLDKAERL LSEAAENGSQ LVVFPEAFIG GYPRGSTFEL AIGSTTAKGR DDFRKYHASA IDVPGPEVER LALMAKKYKV YLVMGVIERE GYTLYCTVLF FDSQGLFLGK HRKLMPTALE RCIWGFGDGS TIPVFDTPIG KIGAAICWEN RMPSLRTAMY AKGIEIYCAP TADSRETWLA SMTHIALEGG CFVLSANQFC RRKDYPSPPE YMFSGSEESL TPDSVVCAGG SSIISPLGIV LAGPNYRGEA LITADLDLGD IARAKFDFDV VGHYSRPEVF SLNIREHPRK AVSFKTSKVM EDESV |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.3 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| |||||||||
| 染色 | タイプ: NEGATIVE / 材質: Uranyl Acetate 詳細: The protein was allowed to adhere for 30 s, blotted, washed three-times with distilled water and stained with uranyl acetate, blotted again and allowed to dry at room temperature. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / 撮影したグリッド数: 1 / 実像数: 30 / 平均露光時間: 1.0 sec. / 平均電子線量: 20.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 最大 デフォーカス(補正後): 0.5 µm / 最小 デフォーカス(補正後): 0.3 µm / 倍率(補正後): 50200 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 1.2 mm / 最大 デフォーカス(公称値): 0.5 µm / 最小 デフォーカス(公称値): 0.3 µm / 倍率(公称値): 50000 |
| 試料ステージ | 試料ホルダーモデル: PHILIPS ROTATION HOLDER |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 16.0 Å 想定した対称性 - らせんパラメータ - ΔΦ: -73 ° 想定した対称性 - らせんパラメータ - 軸対称性: D2 (2回x2回 2面回転対称) アルゴリズム: BACK PROJECTION / 解像度のタイプ: BY AUTHOR / 解像度: 20.0 Å / 解像度の算出法: FSC 1/2 BIT CUT-OFF / ソフトウェア - 名称: SPIDER (ver. 11) / ソフトウェア - 詳細: IHRSR / 使用した粒子像数: 3167 |
|---|---|
| Segment selection | 選択した数: 1015 / ソフトウェア - 名称: EMAN / ソフトウェア - 詳細: Boxer / 詳細: Picked using Eman Boxer in helix mode |
| 初期モデル | モデルのタイプ: INSILICO MODEL In silico モデル: Featureless cylinder approximating the diameter of the filament. |
| 最終 角度割当 | タイプ: NOT APPLICABLE / ソフトウェア - 名称: SPIDER (ver. 11) / ソフトウェア - 詳細: IHRSR |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















