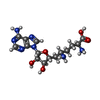
登録情報 データベース : EMDB / ID : EMD-47478タイトル Cryo-EM structure of PRMT5/WDR77 in complex with 6S complex (GRG local refine) Map of locally refined PRMT5/GRG active site 複合体 : PRMT5/WDR77 in complex with 6S (GRG active site local refine)複合体 : PRMT5/WDR77タンパク質・ペプチド : Protein arginine N-methyltransferase 5複合体 : 6S complex複合体 : Methylosome subunit pICln複合体 : Small nuclear ribonucleoprotein Sm D1タンパク質・ペプチド : Small nuclear ribonucleoprotein Sm D1複合体 : Small nuclear ribonucleoproteins E, F, Gリガンド : SINEFUNGIN / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / 解像度 : 3.19 Å Jin CY / Hunkeler M / Fischer ES 資金援助 Organization Grant number 国 National Institutes of Health/National Cancer Institute (NIH/NCI) R01CA262188
ジャーナル : J Biol Chem / 年 : 2025タイトル : Substrate adaptors are flexible tethering modules that enhance substrate methylation by the arginine methyltransferase PRMT5.著者 : Cyrus Y Jin / Moritz Hunkeler / Kathleen M Mulvaney / William R Sellers / Eric S Fischer / 要旨 : Protein arginine methyltransferase (PRMT) 5 is an essential arginine methyltransferase responsible for the majority of cellular symmetric dimethyl-arginine marks. PRMT5 uses substrate adaptors such ... Protein arginine methyltransferase (PRMT) 5 is an essential arginine methyltransferase responsible for the majority of cellular symmetric dimethyl-arginine marks. PRMT5 uses substrate adaptors such as pICln, RIOK1, and COPR5 to recruit and methylate a wide range of substrates. Although the substrate adaptors play important roles in substrate recognition, how they direct PRMT5 activity towards specific substrates remains incompletely understood. Using biochemistry and cryogenic electron microscopy, we show that these adaptors compete for the same binding site on PRMT5. We find that substrate adaptor and substrate complexes are bound to PRMT5 through two peptide motifs, enabling these adaptors to act as flexible tethering modules to enhance substrate methylation. Taken together, our results shed structural and mechanistic light on the PRMT5 substrate adaptor function and the biochemical nature of PRMT5 interactors. 履歴 登録 2024年10月23日 - ヘッダ(付随情報) 公開 2025年2月19日 - マップ公開 2025年2月19日 - 更新 2025年2月19日 - 現状 2025年2月19日 処理サイト : RCSB / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報
 マップデータ
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: J Biol Chem / 年: 2025
ジャーナル: J Biol Chem / 年: 2025
 構造の表示
構造の表示 ダウンロードとリンク
ダウンロードとリンク emd_47478.map.gz
emd_47478.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-47478-v30.xml
emd-47478-v30.xml emd-47478.xml
emd-47478.xml EMDBヘッダ
EMDBヘッダ emd_47478_fsc.xml
emd_47478_fsc.xml FSCデータファイル
FSCデータファイル emd_47478.png
emd_47478.png emd_47478_msk_1.map
emd_47478_msk_1.map マスクマップ
マスクマップ emd-47478.cif.gz
emd-47478.cif.gz emd_47478_half_map_1.map.gz
emd_47478_half_map_1.map.gz emd_47478_half_map_2.map.gz
emd_47478_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-47478
http://ftp.pdbj.org/pub/emdb/structures/EMD-47478 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-47478
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-47478 emd_47478_validation.pdf.gz
emd_47478_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_47478_full_validation.pdf.gz
emd_47478_full_validation.pdf.gz emd_47478_validation.xml.gz
emd_47478_validation.xml.gz emd_47478_validation.cif.gz
emd_47478_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47478
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47478 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47478
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47478 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_47478.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_47478.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) emd_47478_msk_1.map
emd_47478_msk_1.map 試料の構成要素
試料の構成要素 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Trichoplusia ni (イラクサキンウワバ)
Trichoplusia ni (イラクサキンウワバ) Homo sapiens (ヒト)
Homo sapiens (ヒト)
 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)














































