+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | h-LysRS bound to unmodified tRNA-Lys3 (Undocked State, AMP bound) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | LysRS / undocked state / unmodified tRNALys3 / aminoacylation / TRANSLATION | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ATP:ADP adenylyltransferase activity / basophil activation involved in immune response / positive regulation of inflammatory response to antigenic stimulus / Mitochondrial tRNA aminoacylation / Selenoamino acid metabolism / lysine-tRNA ligase / lysine-tRNA ligase activity / lysyl-tRNA aminoacylation / diadenosine tetraphosphate biosynthetic process / Cytosolic tRNA aminoacylation ...ATP:ADP adenylyltransferase activity / basophil activation involved in immune response / positive regulation of inflammatory response to antigenic stimulus / Mitochondrial tRNA aminoacylation / Selenoamino acid metabolism / lysine-tRNA ligase / lysine-tRNA ligase activity / lysyl-tRNA aminoacylation / diadenosine tetraphosphate biosynthetic process / Cytosolic tRNA aminoacylation / aminoacyl-tRNA synthetase multienzyme complex / positive regulation of macrophage activation / tRNA processing / amino acid binding / response to X-ray / ERK1 and ERK2 cascade / Transcriptional and post-translational regulation of MITF-M expression and activity / 転移酵素; リンを含む基を移すもの; 核酸を移すもの / tRNA binding / mitochondrial matrix / positive regulation of DNA-templated transcription / protein homodimerization activity / mitochondrion / extracellular space / nucleoplasm / ATP binding / identical protein binding / nucleus / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | |||||||||
 データ登録者 データ登録者 | Devarkar SC / Xiong Y | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nucleic Acids Res / 年: 2025 ジャーナル: Nucleic Acids Res / 年: 2025タイトル: Structural basis for aminoacylation of cellular modified tRNALys3 by human lysyl-tRNA synthetase. 著者: Swapnil C Devarkar / Christina R Budding / Chathuri Pathirage / Arundhati Kavoor / Cassandra Herbert / Patrick A Limbach / Karin Musier-Forsyth / Yong Xiong /  要旨: The average eukaryotic transfer ribonucleic acid (tRNA) contains 13 post-transcriptional modifications; however, their functional impact is largely unknown. Our understanding of the complex tRNA ...The average eukaryotic transfer ribonucleic acid (tRNA) contains 13 post-transcriptional modifications; however, their functional impact is largely unknown. Our understanding of the complex tRNA aminoacylation machinery in metazoans also remains limited. Herein, using a series of high-resolution cryo-electron microscopy (cryo-EM) structures, we provide the mechanistic basis for recognition and aminoacylation of fully modified cellular tRNALys3 by human lysyl-tRNA synthetase (h-LysRS). The tRNALys3 anticodon loop modifications S34 (mcm5s2U) and R37 (ms2t6A) play an integral role in recognition by h-LysRS. Modifications in the T-, variable-, and D-loops of tRNALys3 are critical for ordering the metazoan-specific N-terminal domain of LysRS. The two catalytic steps of tRNALys3 aminoacylation are structurally ordered; docking of the 3'-CCA end in the active site cannot proceed until the lysyl-adenylate intermediate is formed and the pyrophosphate byproduct is released. Association of the h-LysRS-tRNALys3 complex with a multi-tRNA synthetase complex-derived peptide shifts the equilibrium toward the 3'-CCA end "docked" conformation and allosterically increases h-LysRS catalytic efficiency. The insights presented here have broad implications for understanding the role of tRNA modifications in protein synthesis, the human aminoacylation machinery, and the growing catalog of metabolic and neurological diseases linked to it. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_47094.map.gz emd_47094.map.gz | 32.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-47094-v30.xml emd-47094-v30.xml emd-47094.xml emd-47094.xml | 16 KB 16 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_47094_fsc.xml emd_47094_fsc.xml | 8.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_47094.png emd_47094.png | 56.6 KB | ||
| Filedesc metadata |  emd-47094.cif.gz emd-47094.cif.gz | 6.2 KB | ||
| その他 |  emd_47094_half_map_1.map.gz emd_47094_half_map_1.map.gz emd_47094_half_map_2.map.gz emd_47094_half_map_2.map.gz | 59.3 MB 59.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-47094 http://ftp.pdbj.org/pub/emdb/structures/EMD-47094 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-47094 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-47094 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_47094_validation.pdf.gz emd_47094_validation.pdf.gz | 887.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_47094_full_validation.pdf.gz emd_47094_full_validation.pdf.gz | 886.5 KB | 表示 | |
| XML形式データ |  emd_47094_validation.xml.gz emd_47094_validation.xml.gz | 16.5 KB | 表示 | |
| CIF形式データ |  emd_47094_validation.cif.gz emd_47094_validation.cif.gz | 21.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47094 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47094 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47094 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47094 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_47094.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_47094.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.07 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : h-LysRS bound to unmodified tRNA-Lys3 (Undocked State, AMP bound)
| 全体 | 名称: h-LysRS bound to unmodified tRNA-Lys3 (Undocked State, AMP bound) |
|---|---|
| 要素 |
|
-超分子 #1: h-LysRS bound to unmodified tRNA-Lys3 (Undocked State, AMP bound)
| 超分子 | 名称: h-LysRS bound to unmodified tRNA-Lys3 (Undocked State, AMP bound) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Lysine--tRNA ligase
| 分子 | 名称: Lysine--tRNA ligase / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO EC番号: 転移酵素; リンを含む基を移すもの; 核酸を移すもの |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 68.143953 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAAVQAAEVK VDGSEPKLSK NELKRRLKAE KKVAEKEAKQ KELSEKQLSQ ATAAATNHTT DNGVGPEEES VDPNQYYKIR SQAIHQLKV NGEDPYPHKF HVDISLTDFI QKYSHLQPGD HLTDITLKVA GRIHAKRASG GKLIFYDLRG EGVKLQVMAN S RNYKSEEE ...文字列: MAAVQAAEVK VDGSEPKLSK NELKRRLKAE KKVAEKEAKQ KELSEKQLSQ ATAAATNHTT DNGVGPEEES VDPNQYYKIR SQAIHQLKV NGEDPYPHKF HVDISLTDFI QKYSHLQPGD HLTDITLKVA GRIHAKRASG GKLIFYDLRG EGVKLQVMAN S RNYKSEEE FIHINNKLRR GDIIGVQGNP GKTKKGELSI IPYEITLLSP CLHMLPHLHF GLKDKETRYR QRYLDLILND FV RQKFIIR SKIITYIRSF LDELGFLEIE TPMMNIIPGG AVAKPFITYH NELDMNLYMR IAPELYHKML VVGGIDRVYE IGR QFRNEG IDLTHNPEFT TCEFYMAYAD YHDLMEITEK MVSGMVKHIT GSYKVTYHPD GPEGQAYDVD FTPPFRRINM VEEL EKALG MKLPETNLFE TEETRKILDD ICVAKAVECP PPRTTARLLD KLVGEFLEVT CINPTFICDH PQIMSPLAKW HRSKE GLTE RFELFVMKKE ICNAYTELND PMRQRQLFEE QAKAKAAGDD EAMFIDENFC TALEYGLPPT AGWGMGIDRV AMFLTD SNN IKEVLLFPAM KPEDKKENVA TTDTLESTTV GTSV UniProtKB: Lysine--tRNA ligase |
-分子 #2: tRNA-Lys3 (Unmodified)
| 分子 | 名称: tRNA-Lys3 (Unmodified) / タイプ: rna / ID: 2 / コピー数: 1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 24.44748 KDa |
| 配列 | 文字列: GCCCGGAUAG CUCAGUCGGU AGAGCAUCAG ACUUUUAAUC UGAGGGUCCA GGGUUCAAGU CCCUGUUCGG GCGCCA GENBANK: GENBANK: L10753.1 |
-分子 #3: LYSINE
| 分子 | 名称: LYSINE / タイプ: ligand / ID: 3 / コピー数: 2 / 式: LYS |
|---|---|
| 分子量 | 理論値: 147.195 Da |
| Chemical component information | 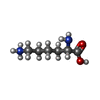 ChemComp-LYS: |
-分子 #4: ADENOSINE MONOPHOSPHATE
| 分子 | 名称: ADENOSINE MONOPHOSPHATE / タイプ: ligand / ID: 4 / コピー数: 2 / 式: AMP |
|---|---|
| 分子量 | 理論値: 347.221 Da |
| Chemical component information |  ChemComp-AMP: |
-分子 #5: SODIUM ION
| 分子 | 名称: SODIUM ION / タイプ: ligand / ID: 5 / コピー数: 1 |
|---|---|
| 分子量 | 理論値: 22.99 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 81000 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 267590 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
 ムービー
ムービー コントローラー
コントローラー












