+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Azotobacter vinelandii MoFeP (C2 symmetry) | ||||||||||||
 マップデータ マップデータ | Sharpened EM map of MoFeP; C2 symmetry | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Nitrogenase / FeMoCo / nitrogen / P-cluster / METAL BINDING PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報molybdenum-iron nitrogenase complex / nitrogenase / nitrogenase activity / nitrogen fixation / iron-sulfur cluster binding / ATP binding / metal ion binding 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Azotobacter vinelandii (窒素固定) Azotobacter vinelandii (窒素固定) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.67 Å | ||||||||||||
 データ登録者 データ登録者 | Narehood SM / Cook BD / Srisantitham S / Eng VH / Shiau A / Britt RD / Herzik MA / Tezcan FA | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2025 ジャーナル: Nature / 年: 2025タイトル: Structural basis for the conformational protection of nitrogenase from O. 著者: Sarah M Narehood / Brian D Cook / Suppachai Srisantitham / Vanessa H Eng / Angela A Shiau / Kelly L McGuire / R David Britt / Mark A Herzik / F Akif Tezcan /  要旨: The low reduction potentials required for the reduction of dinitrogen (N) render metal-based nitrogen-fixation catalysts vulnerable to irreversible damage by dioxygen (O). Such O sensitivity ...The low reduction potentials required for the reduction of dinitrogen (N) render metal-based nitrogen-fixation catalysts vulnerable to irreversible damage by dioxygen (O). Such O sensitivity represents a major conundrum for the enzyme nitrogenase, as a large fraction of nitrogen-fixing organisms are either obligate aerobes or closely associated with O-respiring organisms to support the high energy demand of catalytic N reduction. To counter O damage to nitrogenase, diazotrophs use O scavengers, exploit compartmentalization or maintain high respiration rates to minimize intracellular O concentrations. A last line of damage control is provided by the 'conformational protection' mechanism, in which a [2Fe:2S] ferredoxin-family protein termed FeSII (ref. ) is activated under O stress to form an O-resistant complex with the nitrogenase component proteins. Despite previous insights, the molecular basis for the conformational O protection of nitrogenase and the mechanism of FeSII activation are not understood. Here we report the structural characterization of the Azotobacter vinelandii FeSII-nitrogenase complex by cryo-electron microscopy. Our studies reveal a core complex consisting of two molybdenum-iron proteins (MoFePs), two iron proteins (FePs) and one FeSII homodimer, which polymerize into extended filaments. In this three-protein complex, FeSII mediates an extensive network of interactions with MoFeP and FeP to position their iron-sulphur clusters in catalytically inactive but O-protected states. The architecture of the FeSII-nitrogenase complex is confirmed by solution studies, which further indicate that the activation of FeSII involves an oxidation-induced conformational change. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_45923.map.gz emd_45923.map.gz | 203.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-45923-v30.xml emd-45923-v30.xml emd-45923.xml emd-45923.xml | 29 KB 29 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_45923_fsc.xml emd_45923_fsc.xml | 12.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_45923.png emd_45923.png | 50.6 KB | ||
| マスクデータ |  emd_45923_msk_1.map emd_45923_msk_1.map | 216 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-45923.cif.gz emd-45923.cif.gz | 7.8 KB | ||
| その他 |  emd_45923_additional_1.map.gz emd_45923_additional_1.map.gz emd_45923_half_map_1.map.gz emd_45923_half_map_1.map.gz emd_45923_half_map_2.map.gz emd_45923_half_map_2.map.gz | 108.1 MB 199.9 MB 199.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-45923 http://ftp.pdbj.org/pub/emdb/structures/EMD-45923 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45923 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45923 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_45923_validation.pdf.gz emd_45923_validation.pdf.gz | 1.2 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_45923_full_validation.pdf.gz emd_45923_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  emd_45923_validation.xml.gz emd_45923_validation.xml.gz | 21.7 KB | 表示 | |
| CIF形式データ |  emd_45923_validation.cif.gz emd_45923_validation.cif.gz | 28.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45923 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45923 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45923 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45923 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_45923.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_45923.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened EM map of MoFeP; C2 symmetry | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.735 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_45923_msk_1.map emd_45923_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Unsharpened EM map of MoFeP; C2 symmetry
| ファイル | emd_45923_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened EM map of MoFeP; C2 symmetry | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map B of MoFeP; C2 symmetry
| ファイル | emd_45923_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map B of MoFeP; C2 symmetry | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map A of MoFeP; C2 symmetry
| ファイル | emd_45923_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map A of MoFeP; C2 symmetry | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Azotobacter vinelandii MoFeP (C2 symmetry)
| 全体 | 名称: Azotobacter vinelandii MoFeP (C2 symmetry) |
|---|---|
| 要素 |
|
-超分子 #1: Azotobacter vinelandii MoFeP (C2 symmetry)
| 超分子 | 名称: Azotobacter vinelandii MoFeP (C2 symmetry) / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Azotobacter vinelandii (窒素固定) Azotobacter vinelandii (窒素固定) |
| 分子量 | 理論値: 230 KDa |
-分子 #1: Nitrogenase molybdenum-iron protein alpha chain
| 分子 | 名称: Nitrogenase molybdenum-iron protein alpha chain / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO / EC番号: nitrogenase |
|---|---|
| 由来(天然) | 生物種:  Azotobacter vinelandii (窒素固定) Azotobacter vinelandii (窒素固定) |
| 分子量 | 理論値: 55.363043 KDa |
| 配列 | 文字列: MTGMSREEVE SLIQEVLEVY PEKARKDRNK HLAVNDPAVT QSKKCIISNK KSQPGLMTIR GCAYAGSKGV VWGPIKDMIH ISHGPVGCG QYSRAGRRNY YIGTTGVNAF VTMNFTSDFQ EKDIVFGGDK KLAKLIDEVE TLFPLNKGIS VQSECPIGLI G DDIESVSK ...文字列: MTGMSREEVE SLIQEVLEVY PEKARKDRNK HLAVNDPAVT QSKKCIISNK KSQPGLMTIR GCAYAGSKGV VWGPIKDMIH ISHGPVGCG QYSRAGRRNY YIGTTGVNAF VTMNFTSDFQ EKDIVFGGDK KLAKLIDEVE TLFPLNKGIS VQSECPIGLI G DDIESVSK VKGAELSKTI VPVRCEGFRG VSQSLGHHIA NDAVRDWVLG KRDEDTTFAS TPYDVAIIGD YNIGGDAWSS RI LLEEMGL RCVAQWSGDG SISEIELTPK VKLNLVHCYR SMNYISRHME EKYGIPWMEY NFFGPTKTIE SLRAIAAKFD ESI QKKCEE VIAKYKPEWE AVVAKYRPRL EGKRVMLYIG GLRPRHVIGA YEDLGMEVVG TGYEFAHNDD YDRTMKEMGD STLL YDDVT GYEFEEFVKR IKPDLIGSGI KEKFIFQKMG IPFREMHSWD YSGPYHGFDG FAIFARDMDM TLNNPCWKKL QAPWE ASEG AEKVAASA UniProtKB: Nitrogenase molybdenum-iron protein alpha chain |
-分子 #2: Nitrogenase molybdenum-iron protein beta chain
| 分子 | 名称: Nitrogenase molybdenum-iron protein beta chain / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO / EC番号: nitrogenase |
|---|---|
| 由来(天然) | 生物種:  Azotobacter vinelandii (窒素固定) Azotobacter vinelandii (窒素固定) |
| 分子量 | 理論値: 59.535879 KDa |
| 配列 | 文字列: MSQQVDKIKA SYPLFLDQDY KDMLAKKRDG FEEKYPQDKI DEVFQWTTTK EYQELNFQRE ALTVNPAKAC QPLGAVLCAL GFEKTMPYV HGSQGCVAYF RSYFNRHFRE PVSCVSDSMT EDAAVFGGQQ NMKDGLQNCK ATYKPDMIAV STTCMAEVIG D DLNAFINN ...文字列: MSQQVDKIKA SYPLFLDQDY KDMLAKKRDG FEEKYPQDKI DEVFQWTTTK EYQELNFQRE ALTVNPAKAC QPLGAVLCAL GFEKTMPYV HGSQGCVAYF RSYFNRHFRE PVSCVSDSMT EDAAVFGGQQ NMKDGLQNCK ATYKPDMIAV STTCMAEVIG D DLNAFINN SKKEGFIPDE FPVPFAHTPS FVGSHVTGWD NMFEGIARYF TLKSMDDKVV GSNKKINIVP GFETYLGNFR VI KRMLSEM GVGYSLLSDP EEVLDTPADG QFRMYAGGTT QEEMKDAPNA LNTVLLQPWH LEKTKKFVEG TWKHEVPKLN IPM GLDWTD EFLMKVSEIS GQPIPASLTK ERGRLVDMMT DSHTWLHGKR FALWGDPDFV MGLVKFLLEL GCEPVHILCH NGNK RWKKA VDAILAASPY GKNATVYIGK DLWHLRSLVF TDKPDFMIGN SYGKFIQRDT LHKGKEFEVP LIRIGFPIFD RHHLH RSTT LGYEGAMQIL TTLVNSILER LDEETRGMQA TDYNHDLVR UniProtKB: Nitrogenase molybdenum-iron protein beta chain |
-分子 #3: 3-HYDROXY-3-CARBOXY-ADIPIC ACID
| 分子 | 名称: 3-HYDROXY-3-CARBOXY-ADIPIC ACID / タイプ: ligand / ID: 3 / コピー数: 2 / 式: HCA |
|---|---|
| 分子量 | 理論値: 206.15 Da |
| Chemical component information | 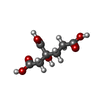 ChemComp-HCA: |
-分子 #4: iron-sulfur-molybdenum cluster with interstitial carbon
| 分子 | 名称: iron-sulfur-molybdenum cluster with interstitial carbon タイプ: ligand / ID: 4 / コピー数: 2 / 式: ICS |
|---|---|
| 分子量 | 理論値: 787.451 Da |
| Chemical component information | 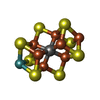 ChemComp-ICE: |
-分子 #5: FE (III) ION
| 分子 | 名称: FE (III) ION / タイプ: ligand / ID: 5 / コピー数: 2 / 式: FE |
|---|---|
| 分子量 | 理論値: 55.845 Da |
-分子 #6: FE(8)-S(7) CLUSTER
| 分子 | 名称: FE(8)-S(7) CLUSTER / タイプ: ligand / ID: 6 / コピー数: 2 / 式: CLF |
|---|---|
| 分子量 | 理論値: 671.215 Da |
| Chemical component information |  ChemComp-CLF: |
-分子 #7: water
| 分子 | 名称: water / タイプ: ligand / ID: 7 / コピー数: 924 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2.5 mg/mL | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| ||||||||||||||||||
| グリッド | モデル: Quantifoil / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 45 sec. | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 75 % / チャンバー内温度: 298.15 K / 装置: SPOTITON 詳細: Samples were frozen with the SPT Labtech chameleon. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: TFS Selectris X / エネルギーフィルター - スリット幅: 10 eV |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / 撮影したグリッド数: 3 / 実像数: 8049 / 平均露光時間: 5.0 sec. / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.75 µm / 倍率(公称値): 165000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






















































