[English] 日本語
 Yorodumi
Yorodumi- PDB-9cu0: Azotobacter vinelandii 1:1:1 MoFeP:FeP:FeSII-Complex (C1 symmetry) -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 9cu0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Title | Azotobacter vinelandii 1:1:1 MoFeP:FeP:FeSII-Complex (C1 symmetry) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Components Components |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Keywords Keywords | METAL BINDING PROTEIN / Nitrogenase / FeMoCo / nitrogen / P-cluster | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Function / homology |  Function and homology information Function and homology informationmolybdenum-iron nitrogenase complex / nitrogenase / nitrogenase activity / nitrogen fixation / iron-sulfur cluster binding / 2 iron, 2 sulfur cluster binding / 4 iron, 4 sulfur cluster binding / ATP binding / metal ion binding / cytoplasm Similarity search - Function | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Biological species |  Azotobacter vinelandii (bacteria) Azotobacter vinelandii (bacteria) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Method | ELECTRON MICROSCOPY / single particle reconstruction / cryo EM / Resolution: 3.94 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Authors Authors | Narehood, S.M. / Cook, B.D. / Srisantitham, S. / Eng, V.H. / Shiau, A. / Britt, R.D. / Herzik, M.A. / Tezcan, F.A. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Funding support |  United States, 3items United States, 3items
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Citation Citation |  Journal: Nature / Year: 2025 Journal: Nature / Year: 2025Title: Structural basis for the conformational protection of nitrogenase from O. Authors: Sarah M Narehood / Brian D Cook / Suppachai Srisantitham / Vanessa H Eng / Angela A Shiau / Kelly L McGuire / R David Britt / Mark A Herzik / F Akif Tezcan /  Abstract: The low reduction potentials required for the reduction of dinitrogen (N) render metal-based nitrogen-fixation catalysts vulnerable to irreversible damage by dioxygen (O). Such O sensitivity ...The low reduction potentials required for the reduction of dinitrogen (N) render metal-based nitrogen-fixation catalysts vulnerable to irreversible damage by dioxygen (O). Such O sensitivity represents a major conundrum for the enzyme nitrogenase, as a large fraction of nitrogen-fixing organisms are either obligate aerobes or closely associated with O-respiring organisms to support the high energy demand of catalytic N reduction. To counter O damage to nitrogenase, diazotrophs use O scavengers, exploit compartmentalization or maintain high respiration rates to minimize intracellular O concentrations. A last line of damage control is provided by the 'conformational protection' mechanism, in which a [2Fe:2S] ferredoxin-family protein termed FeSII (ref. ) is activated under O stress to form an O-resistant complex with the nitrogenase component proteins. Despite previous insights, the molecular basis for the conformational O protection of nitrogenase and the mechanism of FeSII activation are not understood. Here we report the structural characterization of the Azotobacter vinelandii FeSII-nitrogenase complex by cryo-electron microscopy. Our studies reveal a core complex consisting of two molybdenum-iron proteins (MoFePs), two iron proteins (FePs) and one FeSII homodimer, which polymerize into extended filaments. In this three-protein complex, FeSII mediates an extensive network of interactions with MoFeP and FeP to position their iron-sulphur clusters in catalytically inactive but O-protected states. The architecture of the FeSII-nitrogenase complex is confirmed by solution studies, which further indicate that the activation of FeSII involves an oxidation-induced conformational change. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  9cu0.cif.gz 9cu0.cif.gz | 476.7 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb9cu0.ent.gz pdb9cu0.ent.gz | 387.4 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  9cu0.json.gz 9cu0.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/cu/9cu0 https://data.pdbj.org/pub/pdb/validation_reports/cu/9cu0 ftp://data.pdbj.org/pub/pdb/validation_reports/cu/9cu0 ftp://data.pdbj.org/pub/pdb/validation_reports/cu/9cu0 | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  45924MC  9ctzC  9cu1C  9cu2C M: map data used to model this data C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 |
|
- Components
Components
-Nitrogenase molybdenum-iron protein ... , 2 types, 4 molecules ACBD
| #1: Protein | Mass: 55363.043 Da / Num. of mol.: 2 / Source method: isolated from a natural source / Source: (natural)  Azotobacter vinelandii (bacteria) / References: UniProt: P07328, nitrogenase Azotobacter vinelandii (bacteria) / References: UniProt: P07328, nitrogenase#2: Protein | Mass: 59535.879 Da / Num. of mol.: 2 / Source method: isolated from a natural source / Source: (natural)  Azotobacter vinelandii (bacteria) / References: UniProt: P07329, nitrogenase Azotobacter vinelandii (bacteria) / References: UniProt: P07329, nitrogenase |
|---|
-Protein , 2 types, 3 molecules EFG
| #3: Protein | Mass: 31548.240 Da / Num. of mol.: 2 / Source method: isolated from a natural source / Source: (natural)  Azotobacter vinelandii (bacteria) / References: UniProt: P00459, nitrogenase Azotobacter vinelandii (bacteria) / References: UniProt: P00459, nitrogenase#4: Protein | | Mass: 13289.330 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Azotobacter vinelandii (bacteria) / Gene: fesII / Production host: Azotobacter vinelandii (bacteria) / Gene: fesII / Production host:  |
|---|
-Non-polymers , 9 types, 150 molecules 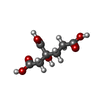
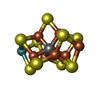







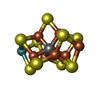







| #5: Chemical | | #6: Chemical | #7: Chemical | #8: Chemical | #9: Chemical | #10: Chemical | #11: Chemical | ChemComp-SF4 / | #12: Chemical | ChemComp-FES / | #13: Water | ChemComp-HOH / | |
|---|
-Details
| Has ligand of interest | Y |
|---|---|
| Has protein modification | N |
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: PARTICLE / 3D reconstruction method: single particle reconstruction |
- Sample preparation
Sample preparation
| Component | Name: Azotobacter vinelandii 1:1:1 MoFeP:FeP:FeSII-Complex (C1 symmetry) Type: COMPLEX / Entity ID: #1-#4 / Source: NATURAL | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Molecular weight | Value: 0.313 MDa / Experimental value: NO | ||||||||||||||||||||||||||||||
| Source (natural) | Organism:  Azotobacter vinelandii (bacteria) Azotobacter vinelandii (bacteria) | ||||||||||||||||||||||||||||||
| Buffer solution | pH: 8 | ||||||||||||||||||||||||||||||
| Buffer component |
| ||||||||||||||||||||||||||||||
| Specimen | Conc.: 2.5 mg/ml / Embedding applied: NO / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES | ||||||||||||||||||||||||||||||
| Specimen support | Grid material: COPPER / Grid mesh size: 300 divisions/in. / Grid type: Quantifoil | ||||||||||||||||||||||||||||||
| Vitrification | Instrument: SPT LABTECH CHAMELEON / Cryogen name: ETHANE / Humidity: 75 % / Chamber temperature: 298.15 K / Details: Samples were frozen with the SPT Labtech chameleon |
- Electron microscopy imaging
Electron microscopy imaging
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
|---|---|
| Microscopy | Model: TFS KRIOS |
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM |
| Electron lens | Mode: BRIGHT FIELD / Nominal magnification: 165000 X / Nominal defocus max: 2500 nm / Nominal defocus min: 750 nm / Cs: 2.7 mm / Alignment procedure: COMA FREE |
| Specimen holder | Cryogen: NITROGEN / Specimen holder model: FEI TITAN KRIOS AUTOGRID HOLDER |
| Image recording | Average exposure time: 5 sec. / Electron dose: 60 e/Å2 / Film or detector model: FEI FALCON IV (4k x 4k) / Num. of grids imaged: 3 / Num. of real images: 8049 |
| EM imaging optics | Energyfilter name: TFS Selectris X / Energyfilter slit width: 10 eV |
| Image scans | Width: 4096 / Height: 4096 |
- Processing
Processing
| EM software |
| ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF correction | Type: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||
| Particle selection | Num. of particles selected: 866869 | ||||||||||||||||||||||||||||||||||||
| Symmetry | Point symmetry: C1 (asymmetric) | ||||||||||||||||||||||||||||||||||||
| 3D reconstruction | Resolution: 3.94 Å / Resolution method: FSC 0.143 CUT-OFF / Num. of particles: 3425 / Algorithm: FOURIER SPACE / Num. of class averages: 1 / Symmetry type: POINT | ||||||||||||||||||||||||||||||||||||
| Atomic model building | B value: 23.9 / Protocol: RIGID BODY FIT / Space: REAL | ||||||||||||||||||||||||||||||||||||
| Atomic model building | PDB-ID: 7UT7 Accession code: 7UT7 / Source name: PDB / Type: experimental model |
 Movie
Movie Controller
Controller





 PDBj
PDBj


















