+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | INF2 at the Barbed End of F-Actin with Incoming Profilin-Actin | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Actin / Filament / Elongation / Ends / CYTOSOLIC PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報synapse maturation / adenyl-nucleotide exchange factor activity / modification of postsynaptic actin cytoskeleton / negative regulation of actin filament bundle assembly / positive regulation of actin filament bundle assembly / negative regulation of actin filament polymerization / regulation of actin filament polymerization / Signaling by ROBO receptors / positive regulation of ATP-dependent activity / proline-rich region binding ...synapse maturation / adenyl-nucleotide exchange factor activity / modification of postsynaptic actin cytoskeleton / negative regulation of actin filament bundle assembly / positive regulation of actin filament bundle assembly / negative regulation of actin filament polymerization / regulation of actin filament polymerization / Signaling by ROBO receptors / positive regulation of ATP-dependent activity / proline-rich region binding / PCP/CE pathway / positive regulation of ruffle assembly / negative regulation of stress fiber assembly / cytoskeletal motor activator activity / myosin heavy chain binding / tropomyosin binding / regulation of mitochondrial fission / actin filament bundle / troponin I binding / filamentous actin / positive regulation of actin filament polymerization / mesenchyme migration / skeletal muscle myofibril / actin filament bundle assembly / striated muscle thin filament / skeletal muscle thin filament assembly / positive regulation of epithelial cell migration / actin monomer binding / skeletal muscle fiber development / stress fiber / titin binding / phosphatidylinositol-4,5-bisphosphate binding / phosphotyrosine residue binding / actin filament polymerization / filopodium / neural tube closure / actin filament / RHO GTPases Activate Formins / modulation of chemical synaptic transmission / small GTPase binding / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / calcium-dependent protein binding / Platelet degranulation / lamellipodium / cell body / actin binding / actin cytoskeleton organization / cell cortex / blood microparticle / cytoskeleton / protein stabilization / hydrolase activity / cadherin binding / protein domain specific binding / focal adhesion / calcium ion binding / positive regulation of gene expression / regulation of transcription by RNA polymerase II / perinuclear region of cytoplasm / glutamatergic synapse / magnesium ion binding / RNA binding / extracellular exosome / ATP binding / identical protein binding / nucleus / membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||
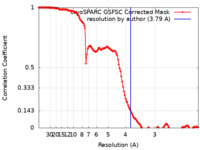
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.79 Å | |||||||||
 データ登録者 データ登録者 | Palmer NJ / Barrie KR / Dominguez R | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: Mechanisms of actin filament severing and elongation by formins. 著者: Nicholas J Palmer / Kyle R Barrie / Roberto Dominguez /  要旨: Humans express 15 formins that play crucial roles in actin-based processes, including cytokinesis, cell motility and mechanotransduction. However, the lack of structures bound to the actin filament ...Humans express 15 formins that play crucial roles in actin-based processes, including cytokinesis, cell motility and mechanotransduction. However, the lack of structures bound to the actin filament (F-actin) has been a major impediment to understanding formin function. Whereas formins are known for their ability to nucleate and elongate F-actin, some formins can additionally depolymerize, sever or bundle F-actin. Two mammalian formins, inverted formin 2 (INF2) and diaphanous 1 (DIA1, encoded by DIAPH1), exemplify this diversity. INF2 shows potent severing activity but elongates weakly whereas DIA1 has potent elongation activity but does not sever. Using cryo-electron microscopy (cryo-EM) we show five structural states of INF2 and two of DIA1 bound to the middle and barbed end of F-actin. INF2 and DIA1 bind differently to these sites, consistent with their distinct activities. The formin-homology 2 and Wiskott-Aldrich syndrome protein-homology 2 (FH2 and WH2, respectively) domains of INF2 are positioned to sever F-actin, whereas DIA1 appears unsuited for severing. These structures also show how profilin-actin is delivered to the fast-growing barbed end, and how this is followed by a transition of the incoming monomer into the F-actin conformation and the release of profilin. Combined, the seven structures presented here provide step-by-step visualization of the mechanisms of F-actin severing and elongation by formins. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_44018.map.gz emd_44018.map.gz | 77.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-44018-v30.xml emd-44018-v30.xml emd-44018.xml emd-44018.xml | 26.2 KB 26.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_44018_fsc.xml emd_44018_fsc.xml | 12.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_44018.png emd_44018.png | 39.7 KB | ||
| マスクデータ |  emd_44018_msk_1.map emd_44018_msk_1.map | 216 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-44018.cif.gz emd-44018.cif.gz | 8.2 KB | ||
| その他 |  emd_44018_half_map_1.map.gz emd_44018_half_map_1.map.gz emd_44018_half_map_2.map.gz emd_44018_half_map_2.map.gz | 200.7 MB 200.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-44018 http://ftp.pdbj.org/pub/emdb/structures/EMD-44018 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44018 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44018 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_44018_validation.pdf.gz emd_44018_validation.pdf.gz | 1.2 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_44018_full_validation.pdf.gz emd_44018_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  emd_44018_validation.xml.gz emd_44018_validation.xml.gz | 21.3 KB | 表示 | |
| CIF形式データ |  emd_44018_validation.cif.gz emd_44018_validation.cif.gz | 27.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44018 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44018 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44018 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44018 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9azpMC  9az4C  9azqC  9b03C  9b0kC  9b27C  9b3dC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_44018.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_44018.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.08 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_44018_msk_1.map emd_44018_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_44018_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_44018_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Actin
| 全体 | 名称: Actin |
|---|---|
| 要素 |
|
-超分子 #1: Actin
| 超分子 | 名称: Actin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 264 KDa |
-超分子 #2: INF2 Dimer
| 超分子 | 名称: INF2 Dimer / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-超分子 #3: Actin Filament
| 超分子 | 名称: Actin Filament / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Actin, alpha skeletal muscle
| 分子 | 名称: Actin, alpha skeletal muscle / タイプ: protein_or_peptide / ID: 1 / コピー数: 7 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 41.387227 KDa |
| 配列 | 文字列: TTALVCDNGS GLVKAGFAGD DAPRAVFPSI VGRPRHQGVM VGMGQKDSYV GDEAQSKRGI LTLKYPIE(HIC)G IITNWD DME KIWHHTFYNE LRVAPEEHPT LLTEAPLNPK ANREKMTQIM FETFNVPAMY VAIQAVLSLY ASGRTTGIVL DSGDGVT HN ...文字列: TTALVCDNGS GLVKAGFAGD DAPRAVFPSI VGRPRHQGVM VGMGQKDSYV GDEAQSKRGI LTLKYPIE(HIC)G IITNWD DME KIWHHTFYNE LRVAPEEHPT LLTEAPLNPK ANREKMTQIM FETFNVPAMY VAIQAVLSLY ASGRTTGIVL DSGDGVT HN VPIYEGYALP HAIMRLDLAG RDLTDYLMKI LTERGYSFVT TAEREIVRDI KEKLCYVALD FENEMATAAS SSSLEKSY E LPDGQVITIG NERFRCPETL FQPSFIGMES AGIHETTYNS IMKCDIDIRK DLYANNVMSG GTTMYPGIAD RMQKEITAL APSTMKIKII APPERKYSVW IGGSILASLS TFQQMWITKQ EYDEAGPSIV HRKCF UniProtKB: Actin, alpha skeletal muscle |
-分子 #2: Inverted formin-2
| 分子 | 名称: Inverted formin-2 / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 135.778828 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSVKEGAQRK WAALKEKLGP QDSDPTEANL ESADPELCIR LLQMPSVVNY SGLRKRLEGS DGGWMVQFLE QSGLDLLLEA LARLSGRGV ARISDALLQL TCVSCVRAVM NSRQGIEYIL SNQGYVRQLS QALDTSNVMV KKQVFELLAA LCIYSPEGHV L TLDALDHY ...文字列: MSVKEGAQRK WAALKEKLGP QDSDPTEANL ESADPELCIR LLQMPSVVNY SGLRKRLEGS DGGWMVQFLE QSGLDLLLEA LARLSGRGV ARISDALLQL TCVSCVRAVM NSRQGIEYIL SNQGYVRQLS QALDTSNVMV KKQVFELLAA LCIYSPEGHV L TLDALDHY KTVCSQQYRF SIVMNELSGS DNVPYVVTLL SVINAVILGP EDLRARTQLR NEFIGLQLLD VLARLRDLED AD LLIQLEA FEEAKAEDEE ELLRVSGGVD MSSHQEVFAS LFHKVSCSPV SAQLLSVLQG LLHLEPTLRS SQLLWEALES LVN RAVLLA SDAQECTLEE VVERLLSVKG RPRPSPLVKA HKSVQANLDQ SQRGSSPQNT TTPKPSVEGQ QPAAAAACEP VDHA QSESI LKVSQPRALE QQASTPPPPP PPPLLPGSSA EPPPPPPPPP LPSVGAKALP TAPPPPPLPG LGAMAPPAPP LPPPL PGSC EFLPPPPPPL PGLGCPPPPP PLLPGMGWGP PPPPPPLLPC TCSPPVAGGM EEVIVAQVDH GLGSAWVPSH RRVNPP TLR MKKLNWQKLP SNVAREHNSM WASLSSPDAE AVEPDFSSIE RLFSFPAAKP KEPTMVAPRA RKEPKEITFL DAKKSLN LN IFLKQFKCSN EEVAAMIRAG DTTKFDVEVL KQLLKLLPEK HEIENLRAFT EERAKLASAD HFYLLLLAIP CYQLRIEC M LLCEGAAAVL DMVRPKAQLV LAACESLLTS RQLPIFCQLI LRIGNFLNYG SHTGDADGFK ISTLLKLTET KSQQNRVTL LHHVLEEAEK SHPDLLQLPR DLEQPSQAAG INLEIIRSEA SSNLKKLLET ERKVSASVAE VQEQYTERLQ ASISAFRALD ELFEAIEQK QRELADYLCE DAQQLSLEDT FSTMKAFRDL FLRALKENKD RKEQAAKAER RKQQLAEEEA RRPRGEDGKP V RKGPGKQE EVCVIDALLA DIRKGFQLRK TARGRGDTDG GSKAASMDPP RATEPVATSN PAGDPVGSTR CPASEPGLDA TT ASESRGW DLVDAVTPGP QPTLEQLEEG GPRPLERRSS WYVDASDVLT TEDPQCPQPL EGAWPVTLGD AQALKPLKFS SNQ PPAAGS SRQDAKDPTS LLGVLQAEAD STSEGLEDAV HSRGARPPAA GPGGDEDEDE EDTAPESALD TSLDKSFSED AVTD SSGSG TLPRARGRAS KGTGKRRKKR PSRSQEEVPP DSDDNKTKKL CVIQ UniProtKB: Inverted formin-2 |
-分子 #3: Profilin-1
| 分子 | 名称: Profilin-1 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 14.940021 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: AGWNAYIDNL MADGTCQDAA IVGYKDSPSV WAAVPGKTFV NITPAEVGVL VGKDRSSFYV NGLTLGGQKC SVIRDSLLQD GEFSMDLRT KSTGGAPTFN VTVTKTDKTL VLLMGKEGVH GGLINKKCYE MASHLRRSQY UniProtKB: Profilin-1 |
-分子 #4: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 4 / コピー数: 6 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #5: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 5 / コピー数: 7 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #6: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 6 / コピー数: 1 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.45 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| ||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 100 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 120 sec. | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 実像数: 41926 / 平均電子線量: 44.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)