+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of a bacterial nitrilase filament with a covalent adduct derived from benzonitrile hydrolysis | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Aromatic-nitrilase / helical-filament / benzaldehyde covalent-adduct intermediate / truncated mutant / HYDROLASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Rhodococcus sp. (in: high G+C Gram-positive bacteria) (バクテリア) Rhodococcus sp. (in: high G+C Gram-positive bacteria) (バクテリア) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.01 Å | |||||||||
 データ登録者 データ登録者 | Aguirre-Sampieri S / Casanal A / Emsley P / Garza-Ramos G | |||||||||
| 資金援助 |  メキシコ, 1件 メキシコ, 1件
| |||||||||
 引用 引用 |  ジャーナル: J Struct Biol / 年: 2024 ジャーナル: J Struct Biol / 年: 2024タイトル: Cryo-EM structure of bacterial nitrilase reveals insight into oligomerization, substrate recognition, and catalysis. 著者: Sergio Aguirre-Sampieri / Ana Casañal / Paul Emsley / Georgina Garza-Ramos /    要旨: Many enzymes can self-assemble into higher-order structures with helical symmetry. A particularly noteworthy example is that of nitrilases, enzymes in which oligomerization of dimers into spiral homo- ...Many enzymes can self-assemble into higher-order structures with helical symmetry. A particularly noteworthy example is that of nitrilases, enzymes in which oligomerization of dimers into spiral homo-oligomers is a requirement for their enzymatic function. Nitrilases are widespread in nature where they catalyze the hydrolysis of nitriles into the corresponding carboxylic acid and ammonia. Here, we present the Cryo-EM structure, at 3 Å resolution, of a C-terminal truncate nitrilase from Rhodococcus sp. V51B that assembles in helical filaments. The model comprises a complete turn of the helical arrangement with a substrate-intermediate bound to the catalytic cysteine. The structure was solved having added the substrate to the protein. The length and stability of filaments was made more substantial in the presence of the aromatic substrate, benzonitrile, but not for aliphatic nitriles or dinitriles. The overall structure maintains the topology of the nitrilase family, and the filament is formed by the association of dimers in a chain-like mechanism that stabilizes the spiral. The active site is completely buried inside each monomer, while the substrate binding pocket was observed within the oligomerization interfaces. The present structure is in a closed configuration, judging by the position of the lid, suggesting that the intermediate is one of the covalent adducts. The proximity of the active site to the dimerization and oligomerization interfaces, allows the dimer to sense structural changes once the benzonitrile was bound, and translated to the rest of the filament, stabilizing the helical structure. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_42779.map.gz emd_42779.map.gz | 163.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-42779-v30.xml emd-42779-v30.xml emd-42779.xml emd-42779.xml | 18.1 KB 18.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_42779_fsc.xml emd_42779_fsc.xml | 12.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_42779.png emd_42779.png | 78.1 KB | ||
| マスクデータ |  emd_42779_msk_1.map emd_42779_msk_1.map | 178 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-42779.cif.gz emd-42779.cif.gz | 6.3 KB | ||
| その他 |  emd_42779_half_map_1.map.gz emd_42779_half_map_1.map.gz emd_42779_half_map_2.map.gz emd_42779_half_map_2.map.gz | 139 MB 138.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-42779 http://ftp.pdbj.org/pub/emdb/structures/EMD-42779 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42779 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42779 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_42779_validation.pdf.gz emd_42779_validation.pdf.gz | 941.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_42779_full_validation.pdf.gz emd_42779_full_validation.pdf.gz | 940.8 KB | 表示 | |
| XML形式データ |  emd_42779_validation.xml.gz emd_42779_validation.xml.gz | 20.4 KB | 表示 | |
| CIF形式データ |  emd_42779_validation.cif.gz emd_42779_validation.cif.gz | 26.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42779 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42779 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42779 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42779 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8uxuMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_42779.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_42779.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.04 Å | ||||||||||||||||||||||||||||||||||||
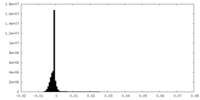
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_42779_msk_1.map emd_42779_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
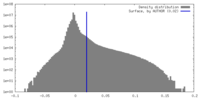
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_42779_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
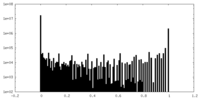
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_42779_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
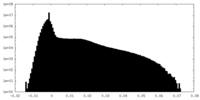
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Bacterial nitrilase filament with covalent adduct derived from be...
| 全体 | 名称: Bacterial nitrilase filament with covalent adduct derived from benzonitrile hydrolysis. |
|---|---|
| 要素 |
|
-超分子 #1: Bacterial nitrilase filament with covalent adduct derived from be...
| 超分子 | 名称: Bacterial nitrilase filament with covalent adduct derived from benzonitrile hydrolysis. タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 / 詳細: C-terminal truncated mutant. |
|---|---|
| 由来(天然) | 生物種:  Rhodococcus sp. (in: high G+C Gram-positive bacteria) (バクテリア) Rhodococcus sp. (in: high G+C Gram-positive bacteria) (バクテリア)株: V51B |
-分子 #1: Nitrilase
| 分子 | 名称: Nitrilase / タイプ: protein_or_peptide / ID: 1 / コピー数: 14 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Rhodococcus sp. (in: high G+C Gram-positive bacteria) (バクテリア) Rhodococcus sp. (in: high G+C Gram-positive bacteria) (バクテリア)株: V51B |
| 分子量 | 理論値: 36.25484 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MVEYTNTFKV AAVQAQPVWF DAAKTVDKTV SNIAEAARNG CELVAFPEVF IPGYPYHIWV DSPLAGMAKF AVRYHENSLT MDSPHVQRL LDAARDHNIA VVVGISERDG GSLYMTQLII DADGQLVARR RKLKPTHVER SVYGEGNGSD ISVYDMPFAR L GALNCWEH ...文字列: MVEYTNTFKV AAVQAQPVWF DAAKTVDKTV SNIAEAARNG CELVAFPEVF IPGYPYHIWV DSPLAGMAKF AVRYHENSLT MDSPHVQRL LDAARDHNIA VVVGISERDG GSLYMTQLII DADGQLVARR RKLKPTHVER SVYGEGNGSD ISVYDMPFAR L GALNCWEH FQTLTKYAMY SMHEQVHVAS WPGMSLYQPE VPAFGVDAQL TATRMYALEG QTFVVCTTQV VTPEAHEFFC EN EEQRKLI GRGGGFARII GPDGRDLATP LAEDEEGILY ADIDLSAITL AKQAADPVGH YSRPDVLSLN FNQRRTTPVN TPL STIHAT H UniProtKB: Nitrilase |
-分子 #2: benzaldehyde
| 分子 | 名称: benzaldehyde / タイプ: ligand / ID: 2 / コピー数: 14 / 式: HBX |
|---|---|
| 分子量 | 理論値: 106.122 Da |
| Chemical component information |  ChemComp-HBX: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 濃度 | 3.8 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.8 構成要素:
詳細: Monobasic and dibasic potassium phosphate mixed at 7.8 pH. | |||||||||
| グリッド | モデル: Quantifoil / 材質: COPPER / 支持フィルム - 材質: GRAPHENE OXIDE / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 283.15 K / 装置: FEI VITROBOT MARK IV 詳細: Grids were glow-discharged for 60 sec before deposition of 3 ul sample, blotted for 4 s, and vitrified by plunging into liquid ethane and stored in a cryobox in liquid nitrogen.. | |||||||||
| 詳細 | Purified protein was centrifuged and incubated with 100 mM benzonitrile for 15 min and applied to the grid. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: COUNTING / 実像数: 2358 / 平均露光時間: 2.04081633 sec. / 平均電子線量: 1.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 5.0 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 75000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Source name: PDB / Chain - Initial model type: experimental model |
|---|---|
| 精密化 | 空間: REAL / プロトコル: BACKBONE TRACE |
| 得られたモデル |  PDB-8uxu: |
-原子モデル構築 2
| 精密化 | 温度因子: 40 |
|---|---|
| 得られたモデル |  PDB-8uxu: |
 ムービー
ムービー コントローラー
コントローラー




 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)