+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM map of synthetic cage_T3_5+2 reconstructed without symmetry (C1) | |||||||||
 マップデータ マップデータ | cage_T3_5 2 refined without symmetry (C1) | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | synthetic / self-assembling / DE NOVO PROTEIN | |||||||||
| 生物種 | synthetic construct (人工物) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 6.7 Å | |||||||||
 データ登録者 データ登録者 | Coudray N / Redler R / Huddy TF / Hsia Y / Baker D / Ekiert D / Bhabha G | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: bioRxiv / 年: 2023 ジャーナル: bioRxiv / 年: 2023タイトル: Blueprinting expandable nanomaterials with standardized protein building blocks. 要旨: A wooden house frame consists of many different lumber pieces, but because of the regularity of these building blocks, the structure can be designed using straightforward geometrical principles. The ...A wooden house frame consists of many different lumber pieces, but because of the regularity of these building blocks, the structure can be designed using straightforward geometrical principles. The design of multicomponent protein assemblies in comparison has been much more complex, largely due to the irregular shapes of protein structures . Here we describe extendable linear, curved, and angled protein building blocks, as well as inter-block interactions that conform to specified geometric standards; assemblies designed using these blocks inherit their extendability and regular interaction surfaces, enabling them to be expanded or contracted by varying the number of modules, and reinforced with secondary struts. Using X-ray crystallography and electron microscopy, we validate nanomaterial designs ranging from simple polygonal and circular oligomers that can be concentrically nested, up to large polyhedral nanocages and unbounded straight "train track" assemblies with reconfigurable sizes and geometries that can be readily blueprinted. Because of the complexity of protein structures and sequence-structure relationships, it has not been previously possible to build up large protein assemblies by deliberate placement of protein backbones onto a blank 3D canvas; the simplicity and geometric regularity of our design platform now enables construction of protein nanomaterials according to "back of an envelope" architectural blueprints. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_40076.map.gz emd_40076.map.gz | 60.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-40076-v30.xml emd-40076-v30.xml emd-40076.xml emd-40076.xml | 23.1 KB 23.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_40076.png emd_40076.png | 54.5 KB | ||
| マスクデータ |  emd_40076_msk_1.map emd_40076_msk_1.map | 125 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-40076.cif.gz emd-40076.cif.gz | 6.1 KB | ||
| その他 |  emd_40076_half_map_1.map.gz emd_40076_half_map_1.map.gz emd_40076_half_map_2.map.gz emd_40076_half_map_2.map.gz | 116 MB 116 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-40076 http://ftp.pdbj.org/pub/emdb/structures/EMD-40076 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40076 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40076 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_40076_validation.pdf.gz emd_40076_validation.pdf.gz | 1006.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_40076_full_validation.pdf.gz emd_40076_full_validation.pdf.gz | 1006 KB | 表示 | |
| XML形式データ |  emd_40076_validation.xml.gz emd_40076_validation.xml.gz | 14.2 KB | 表示 | |
| CIF形式データ |  emd_40076_validation.cif.gz emd_40076_validation.cif.gz | 16.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40076 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40076 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40076 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40076 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_40076.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_40076.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | cage_T3_5 2 refined without symmetry (C1) | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.8248 Å | ||||||||||||||||||||||||||||||||||||
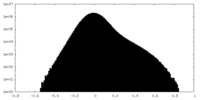
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_40076_msk_1.map emd_40076_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
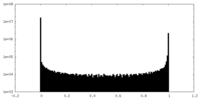
| 密度ヒストグラム |
-ハーフマップ: cage T3 5 2 refined without symmetry (C1), half map B
| ファイル | emd_40076_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | cage_T3_5 2 refined without symmetry (C1), half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
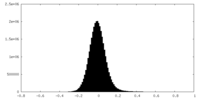
| 密度ヒストグラム |
-ハーフマップ: cage T3 5 2 refined without symmetry (C1), half map A
| ファイル | emd_40076_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | cage_T3_5 2 refined without symmetry (C1), half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
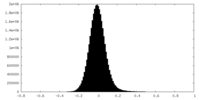
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Expandable de novo designed complex cage_T3_5+2
| 全体 | 名称: Expandable de novo designed complex cage_T3_5+2 |
|---|---|
| 要素 |
|
-超分子 #1: Expandable de novo designed complex cage_T3_5+2
| 超分子 | 名称: Expandable de novo designed complex cage_T3_5+2 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
-分子 #1: cage_T3_5+2
| 分子 | 名称: cage_T3_5+2 / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: mGSVELLAVA ALQELNIELA RALLEAVARL QELNIDLVRK TSELTDEKTI REEIRKVKEE SKRIVEEAEE LIRLAKLASE AIARMAEVAA RGAPPELLIE LLERLLKKAQ EAGMSPEIIH LLLELALAIV EARGVPPEQL AEFAERLVEI LREAGGSPEL VFELLARILE ...文字列: mGSVELLAVA ALQELNIELA RALLEAVARL QELNIDLVRK TSELTDEKTI REEIRKVKEE SKRIVEEAEE LIRLAKLASE AIARMAEVAA RGAPPELLIE LLERLLKKAQ EAGMSPEIIH LLLELALAIV EARGVPPEQL AEFAERLVEI LREAGGSPEL VFELLARILE IIERRGAPPE LLAELAERLV ELAREAGLSP ELVFELLRRA MEIVARRGAP PELLIELLER LLELAREAGL SPRQIYLLLM LALIIVYQRG VPPEQLAEFA EKLKEILREA GGSPELQKAL KELIEAIEEL RGAGGSGGSG GSlehhhhhh |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: CONTINUOUS / 支持フィルム - Film thickness: 2 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 5 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 295 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - スリット幅: 30 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / 撮影したグリッド数: 3 / 実像数: 19358 / 平均露光時間: 2.0 sec. / 平均電子線量: 58.8 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 0.6 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | Chain - Source name: Other / Chain - Initial model type: in silico model / 詳細: de novo designed model |
|---|
 ムービー
ムービー コントローラー
コントローラー

























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)