+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Spiral hexamer of the substrate-free Lon protease with Y397A and S678A mutations | |||||||||
 マップデータ マップデータ | Hexameric state of MtaLon-Y397A-S678A in the presence of ATPgammaS and casein | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | hydrolysis / AAA proteins / HYDROLASE | |||||||||
| 生物種 |  Meiothermus taiwanensis (バクテリア) Meiothermus taiwanensis (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.08 Å | |||||||||
 データ登録者 データ登録者 | Li S / Hsieh KY / Kuo CI / Lee SH / Ho MR / Wang CH / Zhang K / Chang CI | |||||||||
| 資金援助 |  台湾, 1件 台湾, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: A 5+1 assemble-to-activate mechanism of the Lon proteolytic machine. 著者: Shanshan Li / Kan-Yen Hsieh / Chiao-I Kuo / Tzu-Chi Lin / Szu-Hui Lee / Yi-Ru Chen / Chun-Hsiung Wang / Meng-Ru Ho / See-Yeun Ting / Kaiming Zhang / Chung-I Chang /   要旨: Many AAA+ (ATPases associated with diverse cellular activities) proteins function as protein or DNA remodelers by threading the substrate through the central pore of their hexameric assemblies. In ...Many AAA+ (ATPases associated with diverse cellular activities) proteins function as protein or DNA remodelers by threading the substrate through the central pore of their hexameric assemblies. In this ATP-dependent translocating state, the substrate is gripped by the pore loops of the ATPase domains arranged in a universal right-handed spiral staircase organization. However, the process by which a AAA+ protein is activated to adopt this substrate-pore-loop arrangement remains unknown. We show here, using cryo-electron microscopy (cryo-EM), that the activation process of the Lon AAA+ protease may involve a pentameric assembly and a substrate-dependent incorporation of the sixth protomer to form the substrate-pore-loop contacts seen in the translocating state. Based on the structural results, we design truncated monomeric mutants that inhibit Lon activity by binding to the native pentamer and demonstrated that expressing these monomeric mutants in Escherichia coli cells containing functional Lon elicits specific phenotypes associated with lon deficiency, including the inhibition of persister cell formation. These findings uncover a substrate-dependent assembly process for the activation of a AAA+ protein and demonstrate a targeted approach to selectively inhibit its function within cells. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_34006.map.gz emd_34006.map.gz | 71.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-34006-v30.xml emd-34006-v30.xml emd-34006.xml emd-34006.xml | 17.8 KB 17.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_34006.png emd_34006.png | 93.5 KB | ||
| Filedesc metadata |  emd-34006.cif.gz emd-34006.cif.gz | 5.6 KB | ||
| その他 |  emd_34006_half_map_1.map.gz emd_34006_half_map_1.map.gz emd_34006_half_map_2.map.gz emd_34006_half_map_2.map.gz | 134.5 MB 134.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-34006 http://ftp.pdbj.org/pub/emdb/structures/EMD-34006 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34006 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34006 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_34006.map.gz / 形式: CCP4 / 大きさ: 144.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_34006.map.gz / 形式: CCP4 / 大きさ: 144.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Hexameric state of MtaLon-Y397A-S678A in the presence of ATPgammaS and casein | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.061 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half map A
| ファイル | emd_34006_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
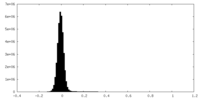
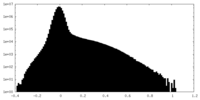
| 密度ヒストグラム |
-ハーフマップ: Half map B
| ファイル | emd_34006_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
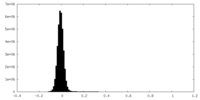
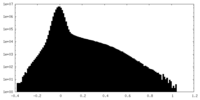
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Hexameric complex of Lon protease with Y397A-S678A mutation
| 全体 | 名称: Hexameric complex of Lon protease with Y397A-S678A mutation |
|---|---|
| 要素 |
|
-超分子 #1: Hexameric complex of Lon protease with Y397A-S678A mutation
| 超分子 | 名称: Hexameric complex of Lon protease with Y397A-S678A mutation タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Meiothermus taiwanensis (バクテリア) Meiothermus taiwanensis (バクテリア) |
| 分子量 | 理論値: 530 KDa |
-分子 #1: Substrate-free hexamer of Lon protease with Y397A and S678A mutations
| 分子 | 名称: Substrate-free hexamer of Lon protease with Y397A and S678A mutations タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Meiothermus taiwanensis (バクテリア) Meiothermus taiwanensis (バクテリア) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MRLELPVIPL RNTVILPHTT TPVDVGRAKS KRAVEEAMGA DRLIFLVAQR DPEVDDPAPD DLYTWGVQA VVKQAMRLPD GTLQVMVEAR ARAQVTDYIP GPYLRARGEV FSEIFPIDEA V VRVLVEEL KEAFEKYVAN HKSLRLDRYQ LEAVKGTSDP AMLADTIAYH ...文字列: MRLELPVIPL RNTVILPHTT TPVDVGRAKS KRAVEEAMGA DRLIFLVAQR DPEVDDPAPD DLYTWGVQA VVKQAMRLPD GTLQVMVEAR ARAQVTDYIP GPYLRARGEV FSEIFPIDEA V VRVLVEEL KEAFEKYVAN HKSLRLDRYQ LEAVKGTSDP AMLADTIAYH ATWTVAEKQE IL ELTDLEA RLKKVLGLLS RDLERFELDK RVAQRVKEQM DTNQREYYLR EQMKAIQKEL GGE DGLSDL EALRKKIEEV GMPEAVKTKA LKELDRLERM QQGSPEATVA RTYLDWLTEV PWSK ADPEV LDINHTRQVL DEDHYGLKDV KERILEYLAV RQLTQGLDVR NKAPILVLVG PPGVG KTSL GRSIARSMNR KFHRISLGGV RDEAEIRGHR RTaIGAMPGK LIHAMKQVGV INPVIL LDE IDKMSSDWRG DPASAMLEVL DPEQNNTFTD HYLDVPYDLS KVFFITTANT LQTIPRP LL DRMEVIEIPG YTNMEKQAIA RQYLWPKQVR ESGMEGRIEV TDAAILRVIS EYTREAGV R GLERELGKIA RKGAKFWLEG AWEGLRTIDA SDIPTYLGIP RYRPDKAETE PQVGTAQGL AWTPVGGTLL TIEVAAVPGS GKLSLTGQLG EVMKESAQAA LTYLRAHTQD YGLPEDFYNK VDLHVHVPD GATPKDGPaA GITMATAIAS ALSRRPARMD IAMTGEVSLR GKVMPIGGVK E KLLAAHQA GIHKIVLPKD NEAQLEELPK EVLEGLEIKL VEDVGEVLEY LLLPEPTMPP VV QPSDNRQ QPGAGA |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| ||||||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K | ||||||||||||||||||
| 詳細 | Lon protease was incubated with alpha-S1-casein |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 5554 / 平均露光時間: 2.0 sec. / 平均電子線量: 48.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.2 µm 最小 デフォーカス(公称値): 1.4000000000000001 µm 倍率(公称値): 81000 |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー




































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)