+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of GluN1b-GluN2D NMDA receptor in complex with agonists glycine and glutamate. | ||||||||||||||||||
 マップデータ マップデータ | |||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||
 キーワード キーワード | ion channel / cryo-EM structure / glutamate receptor / synaptic protein / ELECTRON TRANSPORT | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報glycine-gated cation channel activity / regulation of sensory perception of pain / excitatory chemical synaptic transmission / Synaptic adhesion-like molecules / response to glycine / propylene metabolic process / cellular response to L-glutamate / regulation of monoatomic cation transmembrane transport / Assembly and cell surface presentation of NMDA receptors / NMDA glutamate receptor activity ...glycine-gated cation channel activity / regulation of sensory perception of pain / excitatory chemical synaptic transmission / Synaptic adhesion-like molecules / response to glycine / propylene metabolic process / cellular response to L-glutamate / regulation of monoatomic cation transmembrane transport / Assembly and cell surface presentation of NMDA receptors / NMDA glutamate receptor activity / voltage-gated monoatomic cation channel activity / NMDA selective glutamate receptor complex / neurotransmitter receptor complex / Neurexins and neuroligins / ligand-gated sodium channel activity / glutamate binding / calcium ion transmembrane import into cytosol / protein heterotetramerization / glycine binding / startle response / positive regulation of reactive oxygen species biosynthetic process / monoatomic cation transmembrane transport / Negative regulation of NMDA receptor-mediated neuronal transmission / Unblocking of NMDA receptors, glutamate binding and activation / positive regulation of calcium ion transport into cytosol / Long-term potentiation / monoatomic cation transport / excitatory synapse / regulation of neuronal synaptic plasticity / monoatomic ion channel complex / positive regulation of excitatory postsynaptic potential / positive regulation of synaptic transmission, glutamatergic / synaptic cleft / calcium ion homeostasis / glutamate-gated receptor activity / glutamate-gated calcium ion channel activity / presynaptic active zone membrane / EPHB-mediated forward signaling / ligand-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / sodium ion transmembrane transport / ionotropic glutamate receptor signaling pathway / Ras activation upon Ca2+ influx through NMDA receptor / synaptic membrane / hippocampal mossy fiber to CA3 synapse / adult locomotory behavior / excitatory postsynaptic potential / regulation of membrane potential / transmitter-gated monoatomic ion channel activity involved in regulation of postsynaptic membrane potential / synaptic transmission, glutamatergic / postsynaptic density membrane / brain development / calcium ion transmembrane transport / visual learning / regulation of synaptic plasticity / long-term synaptic potentiation / terminal bouton / synaptic vesicle / signaling receptor activity / amyloid-beta binding / RAF/MAP kinase cascade / response to ethanol / chemical synaptic transmission / dendritic spine / postsynaptic membrane / calmodulin binding / neuron projection / postsynaptic density / synapse / dendrite / calcium ion binding / endoplasmic reticulum membrane / protein-containing complex binding / glutamatergic synapse / cell surface / positive regulation of transcription by RNA polymerase II / plasma membrane / cytoplasm 類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||
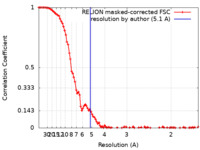
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 5.1 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Zhang JL / Zhu SJ / Zhang M | ||||||||||||||||||
| 資金援助 |  中国, 5件 中国, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2023 ジャーナル: Nat Struct Mol Biol / 年: 2023タイトル: Distinct structure and gating mechanism in diverse NMDA receptors with GluN2C and GluN2D subunits. 著者: Jilin Zhang / Ming Zhang / Qinrui Wang / Han Wen / Zheyi Liu / Fangjun Wang / Yuhang Wang / Fenyong Yao / Nan Song / Zengwei Kou / Yang Li / Fei Guo / Shujia Zhu /  要旨: N-methyl-D-aspartate (NMDA) receptors are heterotetramers comprising two GluN1 and two alternate GluN2 (N2A-N2D) subunits. Here we report full-length cryo-EM structures of the human N1-N2D di- ...N-methyl-D-aspartate (NMDA) receptors are heterotetramers comprising two GluN1 and two alternate GluN2 (N2A-N2D) subunits. Here we report full-length cryo-EM structures of the human N1-N2D di-heterotetramer (di-receptor), rat N1-N2C di-receptor and N1-N2A-N2C tri-heterotetramer (tri-receptor) at a best resolution of 3.0 Å. The bilobate N-terminal domain (NTD) in N2D intrinsically adopts a closed conformation, leading to a compact NTD tetramer in the N1-N2D receptor. Additionally, crosslinking the ligand-binding domain (LBD) of two N1 protomers significantly elevated the channel open probability (Po) in N1-N2D di-receptors. Surprisingly, the N1-N2C di-receptor adopted both symmetric (minor) and asymmetric (major) conformations, the latter further locked by an allosteric potentiator, PYD-106, binding to a pocket between the NTD and LBD in only one N2C protomer. Finally, the N2A and N2C subunits in the N1-N2A-N2C tri-receptor display a conformation close to one protomer in the N1-N2A and N1-N2C di-receptors, respectively. These findings provide a comprehensive structural understanding of diverse function in major NMDA receptor subtypes. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_33793.map.gz emd_33793.map.gz | 9.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-33793-v30.xml emd-33793-v30.xml emd-33793.xml emd-33793.xml | 21.2 KB 21.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_33793_fsc.xml emd_33793_fsc.xml | 10.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_33793.png emd_33793.png | 106.5 KB | ||
| マスクデータ |  emd_33793_msk_1.map emd_33793_msk_1.map | 83.7 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-33793.cif.gz emd-33793.cif.gz | 7.3 KB | ||
| その他 |  emd_33793_half_map_1.map.gz emd_33793_half_map_1.map.gz emd_33793_half_map_2.map.gz emd_33793_half_map_2.map.gz | 63.9 MB 63.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-33793 http://ftp.pdbj.org/pub/emdb/structures/EMD-33793 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33793 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33793 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_33793_validation.pdf.gz emd_33793_validation.pdf.gz | 757.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_33793_full_validation.pdf.gz emd_33793_full_validation.pdf.gz | 757.1 KB | 表示 | |
| XML形式データ |  emd_33793_validation.xml.gz emd_33793_validation.xml.gz | 17 KB | 表示 | |
| CIF形式データ |  emd_33793_validation.cif.gz emd_33793_validation.cif.gz | 22.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33793 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33793 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33793 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33793 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7yfmMC  7yffC  7yfgC  7yfhC  7yfiC  7yflC  7yfoC  7yfrC  8hdkC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_33793.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_33793.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.83 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_33793_msk_1.map emd_33793_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_33793_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_33793_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : NMDA receptor with NMDA 1 incorperated with NMDA 2D
| 全体 | 名称: NMDA receptor with NMDA 1 incorperated with NMDA 2D |
|---|---|
| 要素 |
|
-超分子 #1: NMDA receptor with NMDA 1 incorperated with NMDA 2D
| 超分子 | 名称: NMDA receptor with NMDA 1 incorperated with NMDA 2D / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 株: Homo sapiens / 器官: brain / 組織: brain / Organelle: synapse / 細胞中の位置: plasma membrane Homo sapiens (ヒト) / 株: Homo sapiens / 器官: brain / 組織: brain / Organelle: synapse / 細胞中の位置: plasma membrane |
| 分子量 | 理論値: 384.54 kDa/nm |
-分子 #1: Isoform 6 of Glutamate receptor ionotropic, NMDA 1
| 分子 | 名称: Isoform 6 of Glutamate receptor ionotropic, NMDA 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 97.777914 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MSTMRLLTLA LLFSCSVARA ACDPKIVNIG AVLSTRKHEQ MFREAVNQAN KRHGSWKIQL NATSVTHKPN AIQMALSVCE DLISSQVYA ILVSHPPTPN DHFTPTPVSY TAGFYRIPVL GLTTRMSIYS DKSIHLSFLR TVPPYSHQSS VWFEMMRVYS W NHIILLVS ...文字列: MSTMRLLTLA LLFSCSVARA ACDPKIVNIG AVLSTRKHEQ MFREAVNQAN KRHGSWKIQL NATSVTHKPN AIQMALSVCE DLISSQVYA ILVSHPPTPN DHFTPTPVSY TAGFYRIPVL GLTTRMSIYS DKSIHLSFLR TVPPYSHQSS VWFEMMRVYS W NHIILLVS DDHEGRAAQK RLETLLEERE SKSKKRNYEN LDQLSYDNKR GPKAEKVLQF DPGTKNVTAL LMEAKELEAR VI ILSASED DAATVYRAAA MLNMTGSGYV WLVGEREISG NALRYAPDGI LGLQLINGKN ESAHISDAVG VVAQAVHELL EKE NITDPP RGCVGNTNIW KTGPLFKRVL MSSKYADGVT GRVEFNEDGD RKFANYSIMN LQNRKLVQVG IYNGTHVIPN DRKI IWPGG ETEKPRGYQM STRLKIVTIH QEPFVYVKPT LSDGTCKEEF TVNGDPVKKV ICTGPNDTSP GSPRHTVPQC CYGFC IDLL IKLARTMNFT YEVHLVADGK FGTQERVNNS NKKEWNGMMG ELLSGQADMI VAPLTINNER AQYIEFSKPF KYQGLT ILV KKEIPRSTLD SFMQPFQSTL WLLVGLSVHV VAVMLYLLDR FSPFGRFKVN SEEEEEDALT LSSAMWFSWG VLLNSGI GE GAPRSFSARI LGMVWAGFAM IIVASYTANL AAFLVLDRPE ERITGINDPR LRNPSDKFIY ATVKQSSVDI YFRRQVEL S TMYRHMEKHN YESAAEAIQA VRDNKLHAFI WDSAVLEFEA SQKCDLVTTG ELFFRSGFGI GMRKDSPWKQ NVSLSILKS HENGFMEDLD KTWVRYQECD SRSNAPATLT FENMAGVFML VAGGIVAGIF LIFIEIAYKR HKDARRKQ UniProtKB: Glutamate receptor ionotropic, NMDA 1 |
-分子 #2: Glutamate receptor ionotropic, NMDA 2D
| 分子 | 名称: Glutamate receptor ionotropic, NMDA 2D / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 97.226414 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MRGAGGPRGP RGPAKMLLLL ALACASPFPE EAPGPGGAGG PGGGLGGARP LNVALVFSGP AYAAEAARLG PAVAAAVRSP GLDVRPVAL VLNGSDPRSL VLQLCDLLSG LRVHGVVFED DSRAPAVAPI LDFLSAQTSL PIVAVHGGAA LVLTPKEKGS T FLQLGSST ...文字列: MRGAGGPRGP RGPAKMLLLL ALACASPFPE EAPGPGGAGG PGGGLGGARP LNVALVFSGP AYAAEAARLG PAVAAAVRSP GLDVRPVAL VLNGSDPRSL VLQLCDLLSG LRVHGVVFED DSRAPAVAPI LDFLSAQTSL PIVAVHGGAA LVLTPKEKGS T FLQLGSST EQQLQVIFEV LEEYDWTSFV AVTTRAPGHR AFLSYIEVLT DGSLVGWEHR GALTLDPGAG EAVLSAQLRS VS AQIRLLF CAREEAEPVF RAAEEAGLTG SGYVWFMVGP QLAGGGGSGA PGEPPLLPGG APLPAGLFAV RSAGWRDDLA RRV AAGVAV VARGAQALLR DYGFLPELGH DCRAQNRTHR GESLHRYFMN ITWDNRDYSF NEDGFLVNPS LVVISLTRDR TWEV VGSWE QQTLRLKYPL WSRYGRFLQP VDDTQHLTVA TLEERPFVIV EPADPISGTC IRDSVPCRSQ LNRTHSPPPD APRPE KRCC KGFCIDILKR LAHTIGFSYD LYLVTNGKHG KKIDGVWNGM IGEVFYQRAD MAIGSLTINE ERSEIVDFSV PFVETG ISV MVARSNGTVS PSAFLEPYSP AVWVMMFVMC LTVVAVTVFI FEYLSPVGYN RSLATGKRPG GSTFTIGKSI WLLWALV FN NSVPVENPRG TTSKIMVLVW AFFAVIFLAS YTANLAAFMI QEEYVDTVSG LSDRKFQRPQ EQYPPLKFGT VPNGSTEK N IRSNYPDMHS YMVRYNQPRV EEALTQLKAG KLDAFIYDAA VLNYMARKDE GCKLVTIGSG KVFATTGYGI ALHKGSRWK RPIDLALLQF LGDDEIEMLE RLWLSGICHN DKIEVMSSKL DIDNMAGVFY MLLVAMGLSL LVFAWEHLVY WRLRHCLGPA ASAWSHPQF EK UniProtKB: Glutamate receptor ionotropic, NMDA 2D |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4.0 mg/mL |
|---|---|
| 緩衝液 | pH: 8 / 構成要素 - 濃度: 150.0 mM / 構成要素 - 式: NaCl / 構成要素 - 名称: sodium chloride |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: AIR / 前処理 - 気圧: 101.325 kPa |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 281 K / 装置: FEI VITROBOT MARK IV / 詳細: Blot for 3 seconds before plunging. |
| 詳細 | This sample was monodisperse. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: DIRECT ELECTRON DE-10 (5k x 4k) 検出モード: SUPER-RESOLUTION / デジタル化 - 画像ごとのフレーム数: 1-40 / 撮影したグリッド数: 1 / 実像数: 8700 / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)