+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the Bacterial Ribosome with human tRNA Asp(Q34) and mRNA(GAU) | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | tRNA modifications / decoding / RIBOSOME | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of cytoplasmic translational initiation / ornithine decarboxylase inhibitor activity / transcription antitermination factor activity, RNA binding / misfolded RNA binding / Group I intron splicing / RNA folding / transcriptional attenuation / endoribonuclease inhibitor activity / positive regulation of ribosome biogenesis / RNA-binding transcription regulator activity ...negative regulation of cytoplasmic translational initiation / ornithine decarboxylase inhibitor activity / transcription antitermination factor activity, RNA binding / misfolded RNA binding / Group I intron splicing / RNA folding / transcriptional attenuation / endoribonuclease inhibitor activity / positive regulation of ribosome biogenesis / RNA-binding transcription regulator activity / negative regulation of cytoplasmic translation / four-way junction DNA binding / DnaA-L2 complex / translation repressor activity / negative regulation of translational initiation / regulation of mRNA stability / negative regulation of DNA-templated DNA replication initiation / mRNA regulatory element binding translation repressor activity / assembly of large subunit precursor of preribosome / positive regulation of RNA splicing / ribosome assembly / regulation of DNA-templated transcription elongation / transcription elongation factor complex / cytosolic ribosome assembly / response to reactive oxygen species / DNA endonuclease activity / transcription antitermination / translational initiation / regulation of cell growth / DNA-templated transcription termination / response to radiation / maintenance of translational fidelity / mRNA 5'-UTR binding / ribosome biogenesis / large ribosomal subunit / regulation of translation / ribosome binding / transferase activity / ribosomal small subunit biogenesis / ribosomal small subunit assembly / small ribosomal subunit / 5S rRNA binding / small ribosomal subunit rRNA binding / ribosomal large subunit assembly / cytosolic small ribosomal subunit / large ribosomal subunit rRNA binding / cytosolic large ribosomal subunit / cytoplasmic translation / tRNA binding / negative regulation of translation / rRNA binding / structural constituent of ribosome / ribosome / translation / response to antibiotic / negative regulation of DNA-templated transcription / mRNA binding / DNA binding / RNA binding / zinc ion binding / membrane / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
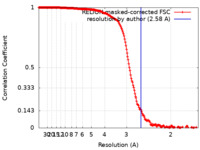
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.58 Å | ||||||||||||
 データ登録者 データ登録者 | Ishiguro K / Yokoyama T / Shirouzu M / Suzuki T | ||||||||||||
| 資金援助 |  日本, 3件 日本, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2023 ジャーナル: Cell / 年: 2023タイトル: Glycosylated queuosines in tRNAs optimize translational rate and post-embryonic growth. 著者: Xuewei Zhao / Ding Ma / Kensuke Ishiguro / Hironori Saito / Shinichiro Akichika / Ikuya Matsuzawa / Mari Mito / Toru Irie / Kota Ishibashi / Kimi Wakabayashi / Yuriko Sakaguchi / Takeshi ...著者: Xuewei Zhao / Ding Ma / Kensuke Ishiguro / Hironori Saito / Shinichiro Akichika / Ikuya Matsuzawa / Mari Mito / Toru Irie / Kota Ishibashi / Kimi Wakabayashi / Yuriko Sakaguchi / Takeshi Yokoyama / Yuichiro Mishima / Mikako Shirouzu / Shintaro Iwasaki / Takeo Suzuki / Tsutomu Suzuki /  要旨: Transfer RNA (tRNA) modifications are critical for protein synthesis. Queuosine (Q), a 7-deaza-guanosine derivative, is present in tRNA anticodons. In vertebrate tRNAs for Tyr and Asp, Q is further ...Transfer RNA (tRNA) modifications are critical for protein synthesis. Queuosine (Q), a 7-deaza-guanosine derivative, is present in tRNA anticodons. In vertebrate tRNAs for Tyr and Asp, Q is further glycosylated with galactose and mannose to generate galQ and manQ, respectively. However, biogenesis and physiological relevance of Q-glycosylation remain poorly understood. Here, we biochemically identified two RNA glycosylases, QTGAL and QTMAN, and successfully reconstituted Q-glycosylation of tRNAs using nucleotide diphosphate sugars. Ribosome profiling of knockout cells revealed that Q-glycosylation slowed down elongation at cognate codons, UAC and GAC (GAU), respectively. We also found that galactosylation of Q suppresses stop codon readthrough. Moreover, protein aggregates increased in cells lacking Q-glycosylation, indicating that Q-glycosylation contributes to proteostasis. Cryo-EM of human ribosome-tRNA complex revealed the molecular basis of codon recognition regulated by Q-glycosylations. Furthermore, zebrafish qtgal and qtman knockout lines displayed shortened body length, implying that Q-glycosylation is required for post-embryonic growth in vertebrates. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_33661.map.gz emd_33661.map.gz | 531.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-33661-v30.xml emd-33661-v30.xml emd-33661.xml emd-33661.xml | 86.4 KB 86.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_33661_fsc.xml emd_33661_fsc.xml | 18.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_33661.png emd_33661.png | 115.5 KB | ||
| Filedesc metadata |  emd-33661.cif.gz emd-33661.cif.gz | 15.1 KB | ||
| その他 |  emd_33661_additional_1.map.gz emd_33661_additional_1.map.gz emd_33661_half_map_1.map.gz emd_33661_half_map_1.map.gz emd_33661_half_map_2.map.gz emd_33661_half_map_2.map.gz | 450.6 MB 456.2 MB 456.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-33661 http://ftp.pdbj.org/pub/emdb/structures/EMD-33661 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33661 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33661 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_33661_validation.pdf.gz emd_33661_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_33661_full_validation.pdf.gz emd_33661_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_33661_validation.xml.gz emd_33661_validation.xml.gz | 26.7 KB | 表示 | |
| CIF形式データ |  emd_33661_validation.cif.gz emd_33661_validation.cif.gz | 35.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33661 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33661 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33661 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33661 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7y7dMC  7y7cC  7y7eC  7y7fC  7y7gC  7y7hC  8jdjC  8jdkC  8jdlC  8jdmC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_33661.map.gz / 形式: CCP4 / 大きさ: 567.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_33661.map.gz / 形式: CCP4 / 大きさ: 567.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.8285 Å | ||||||||||||||||||||||||||||||||||||
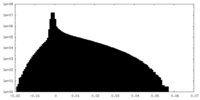
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: before postprocess
| ファイル | emd_33661_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | before postprocess | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
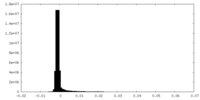
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_33661_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
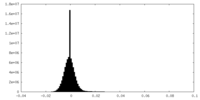
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_33661_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
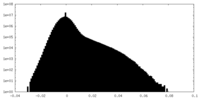
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : The complex of E. coli 70S ribosome with mRNA and A-, P- site tRNA
+超分子 #1: The complex of E. coli 70S ribosome with mRNA and A-, P- site tRNA
+超分子 #2: E. coli 70S ribosome
+超分子 #3: mRNA
+超分子 #4: A-site tRNA
+超分子 #5: P-site tRNA
+分子 #1: 16S rRNA
+分子 #22: 23S rRNA
+分子 #23: 5S rRNA
+分子 #53: mRNA
+分子 #54: P-site tRNA-fMet
+分子 #55: A-site tRNA-Asp
+分子 #2: 30S ribosomal protein S2
+分子 #3: 30S ribosomal protein S3
+分子 #4: 30S ribosomal protein S4
+分子 #5: 30S ribosomal protein S5
+分子 #6: 30S ribosomal protein S6, fully modified isoform
+分子 #7: 30S ribosomal protein S7
+分子 #8: 30S ribosomal protein S8
+分子 #9: 30S ribosomal protein S9
+分子 #10: 30S ribosomal protein S10
+分子 #11: 30S ribosomal protein S11
+分子 #12: 30S ribosomal protein S12
+分子 #13: 30S ribosomal protein S13
+分子 #14: 30S ribosomal protein S14
+分子 #15: 30S ribosomal protein S15
+分子 #16: 30S ribosomal protein S16
+分子 #17: 30S ribosomal protein S17
+分子 #18: 30S ribosomal protein S18
+分子 #19: 30S ribosomal protein S19
+分子 #20: 30S ribosomal protein S20
+分子 #21: 30S ribosomal protein S21
+分子 #24: 50S ribosomal protein L2
+分子 #25: 50S ribosomal protein L3
+分子 #26: 50S ribosomal protein L4
+分子 #27: 50S ribosomal protein L5
+分子 #28: 50S ribosomal protein L6
+分子 #29: 50S ribosomal protein L9
+分子 #30: 50S ribosomal protein L13
+分子 #31: 50S ribosomal protein L14
+分子 #32: 50S ribosomal protein L15
+分子 #33: 50S ribosomal protein L16
+分子 #34: 50S ribosomal protein L17
+分子 #35: 50S ribosomal protein L18
+分子 #36: 50S ribosomal protein L19
+分子 #37: 50S ribosomal protein L20
+分子 #38: 50S ribosomal protein L21
+分子 #39: 50S ribosomal protein L22
+分子 #40: 50S ribosomal protein L23
+分子 #41: 50S ribosomal protein L24
+分子 #42: 50S ribosomal protein L25
+分子 #43: 50S ribosomal protein L27
+分子 #44: 50S ribosomal protein L28
+分子 #45: 50S ribosomal protein L29
+分子 #46: 50S ribosomal protein L30
+分子 #47: 50S ribosomal protein L32
+分子 #48: 50S ribosomal protein L33
+分子 #49: 50S ribosomal protein L34
+分子 #50: 50S ribosomal protein L35
+分子 #51: 50S ribosomal protein L36
+分子 #52: 50S ribosomal protein L31
+分子 #56: MAGNESIUM ION
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.6 構成要素:
詳細: The Buffer pH was adjusted to 7.6 using KOH. | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 10 sec. | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV | |||||||||||||||
| 詳細 | 100nM ribosomes were incubated with 500nM tRNAs and mRNA |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 10994 / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 105000 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー

















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)