+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Consensus map of connexin43/Cx43/GJA1 gap junction intercellular channel in LMNG/CHS detergents at pH ~6.9 | |||||||||
 マップデータ マップデータ | sharpened map | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
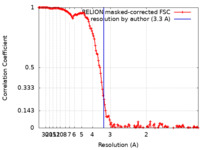
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.3 Å | |||||||||
 データ登録者 データ登録者 | Lee HJ / Cha HJ / Jeong H / Lee SN / Lee CW / Woo JS | |||||||||
| 資金援助 |  韓国, 1件 韓国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Conformational changes in the human Cx43/GJA1 gap junction channel visualized using cryo-EM. 著者: Hyuk-Joon Lee / Hyung Jin Cha / Hyeongseop Jeong / Seu-Na Lee / Chang-Won Lee / Minsoo Kim / Jejoong Yoo / Jae-Sung Woo /  要旨: Connexin family proteins assemble into hexameric hemichannels in the cell membrane. The hemichannels dock together between two adjacent membranes to form gap junction intercellular channels (GJIChs). ...Connexin family proteins assemble into hexameric hemichannels in the cell membrane. The hemichannels dock together between two adjacent membranes to form gap junction intercellular channels (GJIChs). We report the cryo-electron microscopy structures of Cx43 GJICh, revealing the dynamic equilibrium state of various channel conformations in detergents and lipid nanodiscs. We identify three different N-terminal helix conformations of Cx43-gate-covering (GCN), pore-lining (PLN), and flexible intermediate (FIN)-that are randomly distributed in purified GJICh particles. The conformational equilibrium shifts to GCN by cholesteryl hemisuccinates and to PLN by C-terminal truncations and at varying pH. While GJIChs that mainly comprise GCN protomers are occluded by lipids, those containing conformationally heterogeneous protomers show markedly different pore sizes. We observe an α-to-π-helix transition in the first transmembrane helix, which creates a side opening to the membrane in the FIN and PLN conformations. This study provides basic structural information to understand the mechanisms of action and regulation of Cx43 GJICh. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_33399.map.gz emd_33399.map.gz | 27.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-33399-v30.xml emd-33399-v30.xml emd-33399.xml emd-33399.xml | 13.4 KB 13.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_33399_fsc.xml emd_33399_fsc.xml | 14.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_33399.png emd_33399.png | 38.5 KB | ||
| その他 |  emd_33399_half_map_1.map.gz emd_33399_half_map_1.map.gz emd_33399_half_map_2.map.gz emd_33399_half_map_2.map.gz | 192.4 MB 192.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-33399 http://ftp.pdbj.org/pub/emdb/structures/EMD-33399 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33399 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33399 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_33399_validation.pdf.gz emd_33399_validation.pdf.gz | 892.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_33399_full_validation.pdf.gz emd_33399_full_validation.pdf.gz | 892.4 KB | 表示 | |
| XML形式データ |  emd_33399_validation.xml.gz emd_33399_validation.xml.gz | 21.1 KB | 表示 | |
| CIF形式データ |  emd_33399_validation.cif.gz emd_33399_validation.cif.gz | 27.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33399 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33399 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33399 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33399 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_33399.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_33399.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | sharpened map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.675 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: half map
| ファイル | emd_33399_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map | ||||||||||||
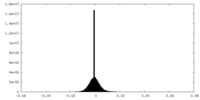
| 投影像・断面図 |
| ||||||||||||
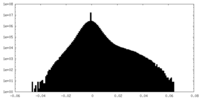
| 密度ヒストグラム |
-ハーフマップ: half map
| ファイル | emd_33399_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map | ||||||||||||
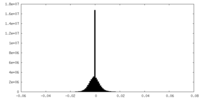
| 投影像・断面図 |
| ||||||||||||
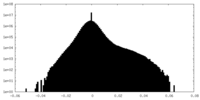
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Dodecameric complex of human Cx43/GJA1 in detergents (LMNG/CHS) a...
| 全体 | 名称: Dodecameric complex of human Cx43/GJA1 in detergents (LMNG/CHS) at pH ~6.9 |
|---|---|
| 要素 |
|
-超分子 #1: Dodecameric complex of human Cx43/GJA1 in detergents (LMNG/CHS) a...
| 超分子 | 名称: Dodecameric complex of human Cx43/GJA1 in detergents (LMNG/CHS) at pH ~6.9 タイプ: complex / ID: 1 / キメラ: Yes / 親要素: 0 / 含まれる分子: all 詳細: Human Cx43 gap junction channel composed of two different protomers in pore-lining and gate-covering NTH conformations |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Gap junction alpha-1 protein (Cx43)
| 分子 | 名称: Gap junction alpha-1 protein (Cx43) / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MGDWSALGKL LDKVQAYSTA GGKVWLSVLF IFRILLLGTA VESAWGDEQS AFRCNTQQPG CENVCYDKSF PISHVRFWVL QIIFVSVPTL LYLAHVFYVM RKEEKLNKKE EELKVAQTDG VNVDMHLKQI EIKKFKYGIE EHGKVKMRGG LLRTYIISIL FKSIFEVAFL ...文字列: MGDWSALGKL LDKVQAYSTA GGKVWLSVLF IFRILLLGTA VESAWGDEQS AFRCNTQQPG CENVCYDKSF PISHVRFWVL QIIFVSVPTL LYLAHVFYVM RKEEKLNKKE EELKVAQTDG VNVDMHLKQI EIKKFKYGIE EHGKVKMRGG LLRTYIISIL FKSIFEVAFL LIQWYIYGFS LSAVYTCKRD PCPHQVDCFL SRPTEKTIFI IFMLVVSLVS LALNIIELFY VFFKGVKDRV KGKSDPYHAT SGALSPAKDC GSQKYAYFNG CSSPTAPLSP MSPPGYKLVT GDRNNSSCRN YNKQASEQNW ANYSAEQNRM GQAGSTISNS HAQPFDFPDD NQNSKKLAAG HELQPLAIVD QRPSSRASSR ASSRPRPDDL EI |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 6.9 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.75 µm / 最小 デフォーカス(公称値): 1.25 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)