+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Hepatitis B virus capsid bound to importin alpha1 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Capsid formed by Cp183 when bound to importin alpha1 / VIRUS LIKE PARTICLE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報microtubule-dependent intracellular transport of viral material towards nucleus / T=4 icosahedral viral capsid / viral penetration into host nucleus / host cell / host cell cytoplasm / symbiont entry into host cell / structural molecule activity / DNA binding / RNA binding / extracellular region 類似検索 - 分子機能 | |||||||||
| 生物種 |   Hepatitis B virus (B 型肝炎ウイルス) Hepatitis B virus (B 型肝炎ウイルス) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.8 Å | |||||||||
 データ登録者 データ登録者 | Yang R / Cingolani G | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2024 ジャーナル: Sci Adv / 年: 2024タイトル: Structural basis for nuclear import of hepatitis B virus (HBV) nucleocapsid core. 著者: Ruoyu Yang / Ying-Hui Ko / Fenglin Li / Ravi K Lokareddy / Chun-Feng David Hou / Christine Kim / Shelby Klein / Santiago Antolínez / Juan F Marín / Carolina Pérez-Segura / Martin F Jarrold ...著者: Ruoyu Yang / Ying-Hui Ko / Fenglin Li / Ravi K Lokareddy / Chun-Feng David Hou / Christine Kim / Shelby Klein / Santiago Antolínez / Juan F Marín / Carolina Pérez-Segura / Martin F Jarrold / Adam Zlotnick / Jodi A Hadden-Perilla / Gino Cingolani /  要旨: Nuclear import of the hepatitis B virus (HBV) nucleocapsid is essential for replication that occurs in the nucleus. The ~360-angstrom HBV capsid translocates to the nuclear pore complex (NPC) as an ...Nuclear import of the hepatitis B virus (HBV) nucleocapsid is essential for replication that occurs in the nucleus. The ~360-angstrom HBV capsid translocates to the nuclear pore complex (NPC) as an intact particle, hijacking human importins in a reaction stimulated by host kinases. This paper describes the mechanisms of HBV capsid recognition by importins. We found that importin α1 binds a nuclear localization signal (NLS) at the far end of the HBV coat protein Cp183 carboxyl-terminal domain (CTD). This NLS is exposed to the capsid surface through a pore at the icosahedral quasi-sixfold vertex. Phosphorylation at serine-155, serine-162, and serine-170 promotes CTD compaction but does not affect the affinity for importin α1. The binding of 30 importin α1/β1 augments HBV capsid diameter to ~620 angstroms, close to the maximum size trafficable through the NPC. We propose that phosphorylation favors CTD externalization and prompts its compaction at the capsid surface, exposing the NLS to importins. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29858.map.gz emd_29858.map.gz | 394.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29858-v30.xml emd-29858-v30.xml emd-29858.xml emd-29858.xml | 13.7 KB 13.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29858_fsc.xml emd_29858_fsc.xml | 17 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29858.png emd_29858.png | 145.6 KB | ||
| Filedesc metadata |  emd-29858.cif.gz emd-29858.cif.gz | 5.2 KB | ||
| その他 |  emd_29858_half_map_1.map.gz emd_29858_half_map_1.map.gz emd_29858_half_map_2.map.gz emd_29858_half_map_2.map.gz | 385.5 MB 388.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29858 http://ftp.pdbj.org/pub/emdb/structures/EMD-29858 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29858 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29858 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29858_validation.pdf.gz emd_29858_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29858_full_validation.pdf.gz emd_29858_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_29858_validation.xml.gz emd_29858_validation.xml.gz | 25.1 KB | 表示 | |
| CIF形式データ |  emd_29858_validation.cif.gz emd_29858_validation.cif.gz | 33.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29858 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29858 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29858 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29858 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29858.map.gz / 形式: CCP4 / 大きさ: 421.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29858.map.gz / 形式: CCP4 / 大きさ: 421.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.108 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_29858_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
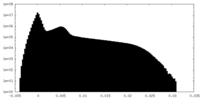
| 投影像・断面図 |
| ||||||||||||
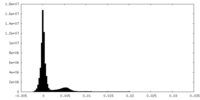
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_29858_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
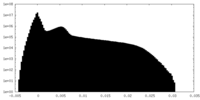
| 投影像・断面図 |
| ||||||||||||
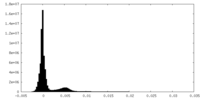
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Capsid formed by Cp183 when importin alpha1 is incorporated
| 全体 | 名称: Capsid formed by Cp183 when importin alpha1 is incorporated |
|---|---|
| 要素 |
|
-超分子 #1: Capsid formed by Cp183 when importin alpha1 is incorporated
| 超分子 | 名称: Capsid formed by Cp183 when importin alpha1 is incorporated タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Hepatitis B virus (B 型肝炎ウイルス) Hepatitis B virus (B 型肝炎ウイルス) |
-分子 #1: Core protein Cp183
| 分子 | 名称: Core protein Cp183 / タイプ: protein_or_peptide / ID: 1 / コピー数: 12 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Hepatitis B virus (B 型肝炎ウイルス) Hepatitis B virus (B 型肝炎ウイルス) |
| 分子量 | 理論値: 16.328719 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDIDPYKEFG ATVELLSFLP SDFFPSVRDL LDTASALYRE ALESPEHCSP HHTALRQAIL CWGELMTLAT WVGVNLEDPA SRDLVVSYV NTNMGLKFRQ LLWFHISCLT FGRETVIEYL VSFGVWIRTP PAYRPPNAPI LSTLP UniProtKB: Capsid protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.25 µm / 最小 デフォーカス(公称値): 0.75 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)