+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
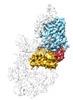
| タイトル | RF3-ppGpp bound to an E. coli rotated ribosome, from focused classification and refinement (State I-C) | ||||||||||||
 マップデータ マップデータ | RF3-ppGpp bound to an E. coli rotated ribosome, from focused classification and refinement (State I-C) | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | release factor 3 / termination complex / cryo-EM / tRNA / RIBOSOME | ||||||||||||
| 生物種 |  | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å | ||||||||||||
 データ登録者 データ登録者 | Rybak MY / Li L / Lin J / Gagnon MG | ||||||||||||
| 資金援助 |  米国, 米国,  中国, 3件 中国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2024 ジャーナル: Nat Struct Mol Biol / 年: 2024タイトル: The ribosome termination complex remodels release factor RF3 and ejects GDP. 著者: Li Li / Mariia Yu Rybak / Jinzhong Lin / Matthieu G Gagnon /   要旨: Translation termination involves release factors RF1, RF2 and the GTPase RF3 that recycles RF1 and RF2 from the ribosome. RF3 dissociates from the ribosome in the GDP-bound form and must then ...Translation termination involves release factors RF1, RF2 and the GTPase RF3 that recycles RF1 and RF2 from the ribosome. RF3 dissociates from the ribosome in the GDP-bound form and must then exchange GDP for GTP. The 70S ribosome termination complex (70S-TC) accelerates GDP exchange in RF3, suggesting that the 70S-TC can function as the guanine nucleotide exchange factor for RF3. Here, we use cryogenic-electron microscopy to elucidate the mechanism of GDP dissociation from RF3 catalyzed by the Escherichia coli 70S-TC. The non-rotated ribosome bound to RF1 remodels RF3 and induces a peptide flip in the phosphate-binding loop, efficiently ejecting GDP. Binding of GTP allows RF3 to dock at the GTPase center, promoting the dissociation of RF1 from the ribosome. The structures recapitulate the functional cycle of RF3 on the ribosome and uncover the mechanism by which the 70S-TC allosterically dismantles the phosphate-binding groove in RF3, a previously overlooked function of the ribosome. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29623.map.gz emd_29623.map.gz | 254.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29623-v30.xml emd-29623-v30.xml emd-29623.xml emd-29623.xml | 18 KB 18 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_29623.png emd_29623.png | 99.2 KB | ||
| マスクデータ |  emd_29623_msk_1.map emd_29623_msk_1.map | 512 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-29623.cif.gz emd-29623.cif.gz | 4.4 KB | ||
| その他 |  emd_29623_additional_1.map.gz emd_29623_additional_1.map.gz emd_29623_half_map_1.map.gz emd_29623_half_map_1.map.gz emd_29623_half_map_2.map.gz emd_29623_half_map_2.map.gz | 483.6 MB 475 MB 475 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29623 http://ftp.pdbj.org/pub/emdb/structures/EMD-29623 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29623 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29623 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29623_validation.pdf.gz emd_29623_validation.pdf.gz | 1.2 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29623_full_validation.pdf.gz emd_29623_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  emd_29623_validation.xml.gz emd_29623_validation.xml.gz | 19 KB | 表示 | |
| CIF形式データ |  emd_29623_validation.cif.gz emd_29623_validation.cif.gz | 22.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29623 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29623 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29623 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29623 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29623.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29623.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | RF3-ppGpp bound to an E. coli rotated ribosome, from focused classification and refinement (State I-C) | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.85 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_29623_msk_1.map emd_29623_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: RF3-ppGpp bound to an E. coli rotated ribosome,...
| ファイル | emd_29623_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | RF3-ppGpp bound to an E. coli rotated ribosome, from focused classification and refinement (State I-C). Sharpened map. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: RF3-ppGpp bound to an E. coli rotated ribosome,...
| ファイル | emd_29623_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | RF3-ppGpp bound to an E. coli rotated ribosome, from focused classification and refinement (State I-C). Half map. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: RF3-ppGpp bound to an E. coli rotated ribosome,...
| ファイル | emd_29623_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | RF3-ppGpp bound to an E. coli rotated ribosome, from focused classification and refinement (State I-C). Half map. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : RF3-ppGpp bound to an E. coli rotated ribosome, from focused clas...
| 全体 | 名称: RF3-ppGpp bound to an E. coli rotated ribosome, from focused classification and refinement (State I-C) |
|---|---|
| 要素 |
|
-超分子 #1: RF3-ppGpp bound to an E. coli rotated ribosome, from focused clas...
| 超分子 | 名称: RF3-ppGpp bound to an E. coli rotated ribosome, from focused classification and refinement (State I-C) タイプ: complex / ID: 1 / 親要素: 0 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 2.6 MDa |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 詳細: 5 mM Tris-HCl, 60 mM NH4Cl, 10 mM MgCl2, 6 mM B-mercaptoethanol |
|---|---|
| グリッド | モデル: Quantifoil R2/1 / 材質: GOLD / メッシュ: 200 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: PLASMA CLEANING / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: OTHER |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 85 % / チャンバー内温度: 295 K / 装置: LEICA EM GP |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: INTEGRATING / 撮影したグリッド数: 1 / 実像数: 10284 / 平均露光時間: 1.0 sec. / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 96000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)