+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-2828 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of Mot1 in complex with TBP, NC2 and DNA | |||||||||
 マップデータ マップデータ | Negative Stain reconstruction of the Mot1 TBP NC2 complex | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Swi/Snf2 / chromatin remodelling / TBP / ATPase | |||||||||
| 生物種 |  Encephalitozoon cuniculi (ウサギエンケファリトゾーン) Encephalitozoon cuniculi (ウサギエンケファリトゾーン) | |||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 22.0 Å | |||||||||
 データ登録者 データ登録者 | Butryn A / Schuller JM / Stoehr G / Runge-Wollmann P / Foerster F / Auble DT / Hopfner K-P | |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2015 ジャーナル: Elife / 年: 2015タイトル: Structural basis for recognition and remodeling of the TBP:DNA:NC2 complex by Mot1. 著者: Agata Butryn / Jan M Schuller / Gabriele Stoehr / Petra Runge-Wollmann / Friedrich Förster / David T Auble / Karl-Peter Hopfner /   要旨: Swi2/Snf2 ATPases remodel substrates such as nucleosomes and transcription complexes to control a wide range of DNA-associated processes, but detailed structural information on the ATP-dependent ...Swi2/Snf2 ATPases remodel substrates such as nucleosomes and transcription complexes to control a wide range of DNA-associated processes, but detailed structural information on the ATP-dependent remodeling reactions is largely absent. The single subunit remodeler Mot1 (modifier of transcription 1) dissociates TATA box-binding protein (TBP):DNA complexes, offering a useful system to address the structural mechanisms of Swi2/Snf2 ATPases. Here, we report the crystal structure of the N-terminal domain of Mot1 in complex with TBP, DNA, and the transcription regulator negative cofactor 2 (NC2). Our data show that Mot1 reduces DNA:NC2 interactions and unbends DNA as compared to the TBP:DNA:NC2 state, suggesting that Mot1 primes TBP:NC2 displacement in an ATP-independent manner. Electron microscopy and cross-linking data suggest that the Swi2/Snf2 domain of Mot1 associates with the upstream DNA and the histone fold of NC2, thereby revealing parallels to some nucleosome remodelers. This study provides a structural framework for how a Swi2/Snf2 ATPase interacts with its substrate DNA:protein complex. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_2828.map.gz emd_2828.map.gz | 12 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-2828-v30.xml emd-2828-v30.xml emd-2828.xml emd-2828.xml | 8 KB 8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  EMD-2828.tif EMD-2828.tif emd_2828.png emd_2828.png | 85.8 KB 136 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2828 http://ftp.pdbj.org/pub/emdb/structures/EMD-2828 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2828 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2828 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_2828_validation.pdf.gz emd_2828_validation.pdf.gz | 223.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_2828_full_validation.pdf.gz emd_2828_full_validation.pdf.gz | 222.7 KB | 表示 | |
| XML形式データ |  emd_2828_validation.xml.gz emd_2828_validation.xml.gz | 5.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2828 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2828 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2828 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2828 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_2828.map.gz / 形式: CCP4 / 大きさ: 12.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_2828.map.gz / 形式: CCP4 / 大きさ: 12.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Negative Stain reconstruction of the Mot1 TBP NC2 complex | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.61 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
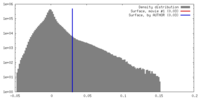
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Mot1 in complex with TBP, NC2a, NC2b and DNA
| 全体 | 名称: Mot1 in complex with TBP, NC2a, NC2b and DNA |
|---|---|
| 要素 |
|
-超分子 #1000: Mot1 in complex with TBP, NC2a, NC2b and DNA
| 超分子 | 名称: Mot1 in complex with TBP, NC2a, NC2b and DNA / タイプ: sample / ID: 1000 詳細: only the C-terminal part of Mot1 was used in the construct Number unique components: 5 |
|---|
-分子 #1: Mot1
| 分子 | 名称: Mot1 / タイプ: protein_or_peptide / ID: 1 / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Encephalitozoon cuniculi (ウサギエンケファリトゾーン) Encephalitozoon cuniculi (ウサギエンケファリトゾーン) |
| 組換発現 | 組換細胞: Sf9 |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.05 mg/mL |
|---|---|
| 緩衝液 | pH: 6.5 / 詳細: 20 mM MES pH, 60 mM KCl, 5 mM MgCl2 and 2 mM DTT |
| 染色 | タイプ: NEGATIVE 詳細: Grids with adsorbed protein floated on 1% w/v uranyl acetate for 20 seconds. |
| グリッド | 詳細: 200 mesh carbon support grid for negative stain |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI/PHILIPS CM200FEG |
|---|---|
| 日付 | 2014年1月28日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) 実像数: 144 / 平均電子線量: 25 e/Å2 |
| 電子線 | 加速電圧: 160 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 62000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 試料ステージ | 試料ホルダーモデル: SIDE ENTRY, EUCENTRIC |
- 画像解析
画像解析
| 詳細 | The particles were manually selected using e2boxer |
|---|---|
| CTF補正 | 詳細: Micrograph level |
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 22.0 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: XMIPP / 使用した粒子像数: 8192 |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)