+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Local refinement of Anykyrin-1 (N-terminal half of membrane binding domain) in Class 2 of erythrocyte ankyrin-1 complex | |||||||||
 マップデータ マップデータ | Main map used for model fitting. Density modified and cropped using phenix.resolve_cryo_em, resampled on fine grid using relion_image_handler. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Membrane Protein / Anion Exchange / Erythrocyte / Glycoprotein / TRANSPORT PROTEIN-STRUCTURAL PROTEIN complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報spectrin-associated cytoskeleton / positive regulation of organelle organization / maintenance of epithelial cell apical/basal polarity / pH elevation / Defective SLC4A1 causes hereditary spherocytosis type 4 (HSP4), distal renal tubular acidosis (dRTA) and dRTA with hemolytic anemia (dRTA-HA) / negative regulation of urine volume / NrCAM interactions / Neurofascin interactions / Bicarbonate transporters / intracellular monoatomic ion homeostasis ...spectrin-associated cytoskeleton / positive regulation of organelle organization / maintenance of epithelial cell apical/basal polarity / pH elevation / Defective SLC4A1 causes hereditary spherocytosis type 4 (HSP4), distal renal tubular acidosis (dRTA) and dRTA with hemolytic anemia (dRTA-HA) / negative regulation of urine volume / NrCAM interactions / Neurofascin interactions / Bicarbonate transporters / intracellular monoatomic ion homeostasis / ankyrin-1 complex / CHL1 interactions / monoatomic anion transmembrane transporter activity / plasma membrane phospholipid scrambling / cytoskeletal anchor activity / chloride:bicarbonate antiporter activity / solute:inorganic anion antiporter activity / bicarbonate transport / bicarbonate transmembrane transporter activity / monoatomic anion transport / M band / chloride transport / chloride transmembrane transporter activity / Interaction between L1 and Ankyrins / ankyrin binding / hemoglobin binding / spectrin binding / negative regulation of glycolytic process through fructose-6-phosphate / erythrocyte development / cortical cytoskeleton / exocytosis / axolemma / endoplasmic reticulum to Golgi vesicle-mediated transport / COPI-mediated anterograde transport / protein-membrane adaptor activity / cytoskeleton organization / chloride transmembrane transport / sarcoplasmic reticulum / regulation of intracellular pH / protein localization to plasma membrane / Erythrocytes take up oxygen and release carbon dioxide / Erythrocytes take up carbon dioxide and release oxygen / sarcolemma / structural constituent of cytoskeleton / transmembrane transport / cytoplasmic side of plasma membrane / Z disc / blood coagulation / ATPase binding / protein phosphatase binding / blood microparticle / basolateral plasma membrane / transmembrane transporter binding / postsynaptic membrane / cytoskeleton / neuron projection / structural molecule activity / enzyme binding / signal transduction / protein homodimerization activity / extracellular exosome / membrane / plasma membrane / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
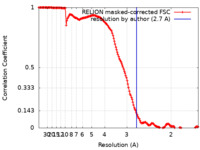
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.7 Å | |||||||||
 データ登録者 データ登録者 | Vallese F / Kim K / Yen LY / Johnston JD / Noble AJ / Cali T / Clarke OB | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2022 ジャーナル: Nat Struct Mol Biol / 年: 2022タイトル: Architecture of the human erythrocyte ankyrin-1 complex. 著者: Francesca Vallese / Kookjoo Kim / Laura Y Yen / Jake D Johnston / Alex J Noble / Tito Calì / Oliver Biggs Clarke /   要旨: The stability and shape of the erythrocyte membrane is provided by the ankyrin-1 complex, but how it tethers the spectrin-actin cytoskeleton to the lipid bilayer and the nature of its association ...The stability and shape of the erythrocyte membrane is provided by the ankyrin-1 complex, but how it tethers the spectrin-actin cytoskeleton to the lipid bilayer and the nature of its association with the band 3 anion exchanger and the Rhesus glycoproteins remains unknown. Here we present structures of ankyrin-1 complexes purified from human erythrocytes. We reveal the architecture of a core complex of ankyrin-1, the Rhesus proteins RhAG and RhCE, the band 3 anion exchanger, protein 4.2, glycophorin A and glycophorin B. The distinct T-shaped conformation of membrane-bound ankyrin-1 facilitates recognition of RhCE and, unexpectedly, the water channel aquaporin-1. Together, our results uncover the molecular details of ankyrin-1 association with the erythrocyte membrane, and illustrate the mechanism of ankyrin-mediated membrane protein clustering. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_26972.map.gz emd_26972.map.gz | 101.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-26972-v30.xml emd-26972-v30.xml emd-26972.xml emd-26972.xml | 37.6 KB 37.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_26972_fsc.xml emd_26972_fsc.xml | 15.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_26972.png emd_26972.png | 48.1 KB | ||
| Filedesc metadata |  emd-26972.cif.gz emd-26972.cif.gz | 8.5 KB | ||
| その他 |  emd_26972_additional_1.map.gz emd_26972_additional_1.map.gz emd_26972_additional_2.map.gz emd_26972_additional_2.map.gz emd_26972_additional_3.map.gz emd_26972_additional_3.map.gz emd_26972_additional_4.map.gz emd_26972_additional_4.map.gz emd_26972_half_map_1.map.gz emd_26972_half_map_1.map.gz emd_26972_half_map_2.map.gz emd_26972_half_map_2.map.gz | 322.1 MB 322.1 MB 564.6 KB 328 MB 101 MB 101 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-26972 http://ftp.pdbj.org/pub/emdb/structures/EMD-26972 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-26972 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-26972 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_26972_validation.pdf.gz emd_26972_validation.pdf.gz | 885 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_26972_full_validation.pdf.gz emd_26972_full_validation.pdf.gz | 884.6 KB | 表示 | |
| XML形式データ |  emd_26972_validation.xml.gz emd_26972_validation.xml.gz | 20.6 KB | 表示 | |
| CIF形式データ |  emd_26972_validation.cif.gz emd_26972_validation.cif.gz | 27.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26972 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26972 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26972 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26972 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8csvMC  7uz3C  7uzeC  7uzqC  7uzsC  7uzuC  7uzvC  7v07C  7v0kC  7v0mC  7v0qC  7v0sC  7v0tC  7v0uC  7v0xC  7v0yC  7v19C  8crqC  8crrC  8crtC  8cs9C  8cslC  8cswC  8csxC  8csyC  8ct2C  8ct3C  8cteC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_26972.map.gz / 形式: CCP4 / 大きさ: 109.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_26972.map.gz / 形式: CCP4 / 大きさ: 109.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Main map used for model fitting. Density modified and cropped using phenix.resolve_cryo_em, resampled on fine grid using relion_image_handler. | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.415 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Half map 2 (unmodified)
| ファイル | emd_26972_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 (unmodified) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Half map 1 (unmodified)
| ファイル | emd_26972_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 (unmodified) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Mask used for FSC calculation
| ファイル | emd_26972_additional_3.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Mask used for FSC calculation | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: B-factor sharpened map.
| ファイル | emd_26972_additional_4.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | B-factor sharpened map. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 1 (cropped and resampled)
| ファイル | emd_26972_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 (cropped and resampled) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 2 (cropped and resampled)
| ファイル | emd_26972_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 (cropped and resampled) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Class 2 of the erythrocyte ankyrin-1 complex (local refinement of...
| 全体 | 名称: Class 2 of the erythrocyte ankyrin-1 complex (local refinement of N-terminal half of membrane binding domain, bound to N-terminal peptide of band3) |
|---|---|
| 要素 |
|
-超分子 #1: Class 2 of the erythrocyte ankyrin-1 complex (local refinement of...
| 超分子 | 名称: Class 2 of the erythrocyte ankyrin-1 complex (local refinement of N-terminal half of membrane binding domain, bound to N-terminal peptide of band3) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Ankyrin-1
| 分子 | 名称: Ankyrin-1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 206.522625 KDa |
| 配列 | 文字列: MPYSVGFREA DAATSFLRAA RSGNLDKALD HLRNGVDINT CNQNGLNGLH LASKEGHVKM VVELLHKEII LETTTKKGNT ALHIAALAG QDEVVRELVN YGANVNAQSQ KGFTPLYMAA QENHLEVVKF LLENGANQNV ATEDGFTPLA VALQQGHENV V AHLINYGT ...文字列: MPYSVGFREA DAATSFLRAA RSGNLDKALD HLRNGVDINT CNQNGLNGLH LASKEGHVKM VVELLHKEII LETTTKKGNT ALHIAALAG QDEVVRELVN YGANVNAQSQ KGFTPLYMAA QENHLEVVKF LLENGANQNV ATEDGFTPLA VALQQGHENV V AHLINYGT KGKVRLPALH IAARNDDTRT AAVLLQNDPN PDVLSKTGFT PLHIAAHYEN LNVAQLLLNR GASVNFTPQN GI TPLHIAS RRGNVIMVRL LLDRGAQIET KTKDELTPLH CAARNGHVRI SEILLDHGAP IQAKTKNGLS PIHMAAQGDH LDC VRLLLQ YDAEIDDITL DHLTPLHVAA HCGHHRVAKV LLDKGAKPNS RALNGFTPLH IACKKNHVRV MELLLKTGAS IDAV TESGL TPLHVASFMG HLPIVKNLLQ RGASPNVSNV KVETPLHMAA RAGHTEVAKY LLQNKAKVNA KAKDDQTPLH CAARI GHTN MVKLLLENNA NPNLATTAGH TPLHIAAREG HVETVLALLE KEASQACMTK KGFTPLHVAA KYGKVRVAEL LLERDA HPN AAGKNGLTPL HVAVHHNNLD IVKLLLPRGG SPHSPAWNGY TPLHIAAKQN QVEVARSLLQ YGGSANAESV QGVTPLH LA AQEGHAEMVA LLLSKQANGN LGNKSGLTPL HLVAQEGHVP VADVLIKHGV MVDATTRMGY TPLHVASHYG NIKLVKFL L QHQADVNAKT KLGYSPLHQA AQQGHTDIVT LLLKNGASPN EVSSDGTTPL AIAKRLGYIS VTDVLKVVTD ETSFVLVSD KHRMSFPETV DEILDVSEDE GEELISFKAE RRDSRDVDEE KELLDFVPKL DQVVESPAIP RIPCAMPETV VIRSEEQEQA SKEYDEDSL IPSSPATETS DNISPVASPV HTGFLVSFMV DARGGSMRGS RHNGLRVVIP PRTCAAPTRI TCRLVKPQKL S TPPPLAEE EGLASRIIAL GPTGAQFLSP VIVEIPHFAS HGRGDRELVV LRSENGSVWK EHRSRYGESY LDQILNGMDE EL GSLEELE KKRVCRIITT DFPLYFVIMS RLCQDYDTIG PEGGSLKSKL VPLVQATFPE NAVTKRVKLA LQAQPVPDEL VTK LLGNQA TFSPIVTVEP RRRKFHRPIG LRIPLPPSWT DNPRDSGEGD TTSLRLLCSV IGGTDQAQWE DITGTTKLVY ANEC ANFTT NVSARFWLSD CPRTAEAVNF ATLLYKELTA VPYMAKFVIF AKMNDPREGR LRCYCMTDDK VDKTLEQHEN FVEVA RSRD IEVLEGMSLF AELSGNLVPV KKAAQQRSFH FQSFRENRLA MPVKVRDSSR EPGGSLSFLR KAMKYEDTQH ILCHLN ITM PPCAKGSGAE DRRRTPTPLA LRYSILSEST PGSLSGTEQA EMKMAVISEH LGLSWAELAR ELQFSVEDIN RIRVENP NS LLEQSVALLN LWVIREGQNA NMENLYTALQ SIDRGEIVNM LEGSGRQSRN LKPDRRHTDR DYSLSPSQMN GYSSLQDE L LSPASLGCAL SSPLRADQYW NEVAVLDAIP LAATEHDTML EMSDMQVWSA GLTPSLVTAE DSSLECSKAE DSDATGHEW KLEGALSEEP RGPELGSLEL VEDDTVDSDA TNGLIDLLEQ EEGQRSEEKL PGSKRQDDAT GAGQDSENEV SLVSGHQRGQ ARITHSPTV SQVTERSQDR LQDWDADGSI VSYLQDAAQG SWQEEVTQGP HSFQGTSTMT EGLEPGGSQE YEKVLVSVSE H TWTEQPEA ESSQADRDRR QQGQEEQVQE AKNTFTQVVQ GNEFQNIPGE QVTEEQFTDE QGNIVTKKII RKVVRQIDLS SA DAAQEHE EVTVEGPLED PSELEVDIDY FMKHSKDHTS TPNP UniProtKB: Ankyrin-1 |
-分子 #2: Band 3 anion transport protein
| 分子 | 名称: Band 3 anion transport protein / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 101.883859 KDa |
| 配列 | 文字列: MEELQDDYED MMEENLEQEE YEDPDIPESQ MEEPAAHDTE ATATDYHTTS HPGTHKVYVE LQELVMDEKN QELRWMEAAR WVQLEENLG ENGAWGRPHL SHLTFWSLLE LRRVFTKGTV LLDLQETSLA GVANQLLDRF IFEDQIRPQD REELLRALLL K HSHAGELE ...文字列: MEELQDDYED MMEENLEQEE YEDPDIPESQ MEEPAAHDTE ATATDYHTTS HPGTHKVYVE LQELVMDEKN QELRWMEAAR WVQLEENLG ENGAWGRPHL SHLTFWSLLE LRRVFTKGTV LLDLQETSLA GVANQLLDRF IFEDQIRPQD REELLRALLL K HSHAGELE ALGGVKPAVL TRSGDPSQPL LPQHSSLETQ LFCEQGDGGT EGHSPSGILE KIPPDSEATL VLVGRADFLE QP VLGFVRL QEAAELEAVE LPVPIRFLFV LLGPEAPHID YTQLGRAAAT LMSERVFRID AYMAQSRGEL LHSLEGFLDC SLV LPPTDA PSEQALLSLV PVQRELLRRR YQSSPAKPDS SFYKGLDLNG GPDDPLQQTG QLFGGLVRDI RRRYPYYLSD ITDA FSPQV LAAVIFIYFA ALSPAITFGG LLGEKTRNQM GVSELLISTA VQGILFALLG AQPLLVVGFS GPLLVFEEAF FSFCE TNGL EYIVGRVWIG FWLILLVVLV VAFEGSFLVR FISRYTQEIF SFLISLIFIY ETFSKLIKIF QDHPLQKTYN YNVLMV PKP QGPLPNTALL SLVLMAGTFF FAMMLRKFKN SSYFPGKLRR VIGDFGVPIS ILIMVLVDFF IQDTYTQKLS VPDGFKV SN SSARGWVIHP LGLRSEFPIW MMFASALPAL LVFILIFLES QITTLIVSKP ERKMVKGSGF HLDLLLVVGM GGVAALFG M PWLSATTVRS VTHANALTVM GKASTPGAAA QIQEVKEQRI SGLLVAVLVG LSILMEPILS RIPLAVLFGI FLYMGVTSL SGIQLFDRIL LLFKPPKYHP DVPYVKRVKT WRMHLFTGIQ IICLAVLWVV KSTPASLALP FVLILTVPLR RVLLPLIFRN VELQCLDAD DAKATFDEEE GRDEYDEVAM PV UniProtKB: Band 3 anion transport protein |
-分子 #3: water
| 分子 | 名称: water / タイプ: ligand / ID: 3 / コピー数: 48 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 8 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 詳細: Final gel filtration buffer contained 0.05% w/v digitonin, 130 mM KCl, 20 mM HEPES, pH 7.4, 1 mM ATP, 1 mM MgCl2, 1 mM PMSF. Peak fractions were concentrated to 8 mg/mL, and 0.01% w/v ...詳細: Final gel filtration buffer contained 0.05% w/v digitonin, 130 mM KCl, 20 mM HEPES, pH 7.4, 1 mM ATP, 1 mM MgCl2, 1 mM PMSF. Peak fractions were concentrated to 8 mg/mL, and 0.01% w/v glycyrrhizic acid was added immediately prior to vitrification. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV / 詳細: 4-6 seconds, wait time 30 seconds. |
| 詳細 | Ankyrin complex mixture purified from digitonin-solubilized erythrocyte ghost membranes |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 2 / 実像数: 14464 / 平均露光時間: 2.5 sec. / 平均電子線量: 58.0 e/Å2 / 詳細: Two grids were imaged in a single session. |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)