+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-24259 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | State 3 of TcdB and FZD2 at pH5 | |||||||||
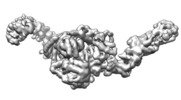
 マップデータ マップデータ | State 3 of TcdB and FZD2 at pH5 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | TOXIN / HYDROLASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報symbiont-mediated perturbation of host actin cytoskeleton via filamentous actin depolymerization / glucosyltransferase activity / host cell cytosol / 転移酵素; グリコシル基を移すもの; 六炭糖残基を移すもの / cysteine-type peptidase activity / host cell endosome membrane / toxin activity / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; システインプロテアーゼ / lipid binding / host cell plasma membrane ...symbiont-mediated perturbation of host actin cytoskeleton via filamentous actin depolymerization / glucosyltransferase activity / host cell cytosol / 転移酵素; グリコシル基を移すもの; 六炭糖残基を移すもの / cysteine-type peptidase activity / host cell endosome membrane / toxin activity / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; システインプロテアーゼ / lipid binding / host cell plasma membrane / proteolysis / extracellular region / metal ion binding / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Clostridioides difficile (バクテリア) Clostridioides difficile (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.6 Å | |||||||||
 データ登録者 データ登録者 | Jiang M / Zhang J | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: Structural Basis for Receptor Recognition of Clostridium difficile Toxin B and its Dissociation upon Acidification 著者: Jiang M / Zhang J | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_24259.map.gz emd_24259.map.gz | 255.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-24259-v30.xml emd-24259-v30.xml emd-24259.xml emd-24259.xml | 12.5 KB 12.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_24259.png emd_24259.png | 56.9 KB | ||
| Filedesc metadata |  emd-24259.cif.gz emd-24259.cif.gz | 6.7 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-24259 http://ftp.pdbj.org/pub/emdb/structures/EMD-24259 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24259 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24259 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_24259_validation.pdf.gz emd_24259_validation.pdf.gz | 329.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_24259_full_validation.pdf.gz emd_24259_full_validation.pdf.gz | 329.2 KB | 表示 | |
| XML形式データ |  emd_24259_validation.xml.gz emd_24259_validation.xml.gz | 7.4 KB | 表示 | |
| CIF形式データ |  emd_24259_validation.cif.gz emd_24259_validation.cif.gz | 8.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24259 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24259 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24259 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24259 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_24259.map.gz / 形式: CCP4 / 大きさ: 299.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_24259.map.gz / 形式: CCP4 / 大きさ: 299.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | State 3 of TcdB and FZD2 at pH5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06065 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : State 3 of TcdB and FZD2 at pH5
| 全体 | 名称: State 3 of TcdB and FZD2 at pH5 |
|---|---|
| 要素 |
|
-超分子 #1: State 3 of TcdB and FZD2 at pH5
| 超分子 | 名称: State 3 of TcdB and FZD2 at pH5 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Clostridioides difficile (バクテリア) Clostridioides difficile (バクテリア) |
| 分子量 | 理論値: 250 KDa |
-分子 #1: Toxin B
| 分子 | 名称: Toxin B / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO EC番号: 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; システインプロテアーゼ |
|---|---|
| 由来(天然) | 生物種:  Clostridioides difficile (バクテリア) Clostridioides difficile (バクテリア) |
| 分子量 | 理論値: 269.807219 KDa |
| 組換発現 | 生物種:  Bacillus megaterium NBRC 15308 = ATCC 14581 (バクテリア) Bacillus megaterium NBRC 15308 = ATCC 14581 (バクテリア) |
| 配列 | 文字列: SLVNRKQLEK MANVRFRTQE DEYVAILDAL EEYHNMSENT VVEKYLKLKD INSLTDIYID TYKKSGRNKA LKKFKEYLVT EVLELKNNN LTPVEKNLHF VWIGGQINDT AINYINQWKD VNSDYNVNVF YDSNAFLINT LKKTVVESAI NDTLESFREN L NDPRFDYN ...文字列: SLVNRKQLEK MANVRFRTQE DEYVAILDAL EEYHNMSENT VVEKYLKLKD INSLTDIYID TYKKSGRNKA LKKFKEYLVT EVLELKNNN LTPVEKNLHF VWIGGQINDT AINYINQWKD VNSDYNVNVF YDSNAFLINT LKKTVVESAI NDTLESFREN L NDPRFDYN KFFRKRMEII YDKQKNFINY YKAQREENPE LIIDDIVKTY LSNEYSKEID ELNTYIEESL NKITQNSGND VR NFEEFKN GESFNLYEQE LVERWNLAAA SDILRISALK EIGGMYLDVD MLPGIQPDLF ESIEKPSSVT VDFWEMTKLE AIM KYKEYI PEYTSEHFDM LDEEVQSSFE SVLASKSDKS EIFSSLGDME ASPLEVKIAF NSKGIINQGL ISVKDSYCSN LIVK QIENR YKILNNSLNP AISEDNDFNT TTNTFIDSIM AEANADNGRF MMELGKYLRV GFFPDVKTTI NLSGPEAYAA AYQDL LMFK EGSMNIHLIE ADLRNFEISK TNISQSTEQE MASLWSFDDA RAKAQFEEYK RNYFEGSLGE DDNLDFSQNI VVDKEY LLE KISSLARSSE RGYIHYIVQL QGDKISYEAA CNLFAKTPYD SVLFQKNIED SEIAYYYNPG DGEIQEIDKY KIPSIIS DR PKIKLTFIGH GKDEFNTDIF AGFDVDSLST EIEAAIDLAK EDISPKSIEI NLLGCNMFSY SINVEETYPG KLLLKVKD K ISELMPSISQ DSIIVSANQY EVRINSEGRR ELLDHSGEWI NKEESIIKDI SSKEYISFNP KENKITVKSK NLPELSTLL QEIRNNSNSS DIELEEKVML TECEINVISN IDTQIVEERI EEAKNLTSDS INYIKDEFKL IESISDALCD LKQQNELEDS HFISFEDIS ETDEGFSIRF INKETGESIF VETEKTIFSE YANHITEEIS KIKGTIFDTV NGKLVKKVNL DTTHEVNTLN A AFFIQSLI EYNSSKESLS NLSVAMKVQV YAQLFSTGLN TITDAAKVVE LVSTALDETI DLLPTLSEGL PIIATIIDGV SL GAAIKEL SETSDPLLRQ EIEAKIGIMA VNLTTATTAI ITSSLGIASG FSILLVPLAG ISAGIPSLVN NELVLRDKAT KVV DYFKHV SLVETEGVFT LLDDKIMMPQ DDLVISEIDF NNNSIVLGKC EIWRMEGGSG HTVTDDIDHF FSAPSITYRE PHLS IYDVL EVQKEELDLS KDLMVLPNAP NRVFAWETGW TPGLRSLEND GTKLLDRIRD NYEGEFYWRY FAFIADALIT TLKPR YEDT NIRINLDSNT RSFIVPIITT EYIREKLSYS FYGSGGTYAL SLSQYNMGIN IELSESDVWI IDVDNVVRDV TIESDK IKK GDLIEGILST LSIEENKIIL NSHEINFSGE VNGSNGFVSL TFSILEGINA IIEVDLLSKS YKLLISGELK ILMLNSN HI QQKIDYIGFN SELQKNIPYS FVDSEGKENG FINGSTKEGL FVSELPDVVL ISKVYMDDSK PSFGYYSNNL KDVKVITK D NVNILTGYYL KDDIKISLSL TLQDEKTIKL NSVHLDESGV AEILKFMNRK GNTNTSDSLM SFLESMNIKS IFVNFLQSN IKFILDANFI ISGTTSIGQF EFICDENDNI QPYFIKFNTL ETNYTLYVGN RQNMIVEPNY DLDDSGDISS TVINFSQKYL YGIDSCVNK VVISPNIYTD EINITPVYET NNTYPEVIVL DANYINEKIN VNINDLSIRY VWSNDGNDFI LMSTSEENKV S QVKIRFVN VFKDKTLANK LSFNFSDKQD VPVSEIILSF TPSYYEDGLI GYDLGLVSLY NEKFYINNFG MMVSGLIYIN DS LYYFKPP VNNLITGFVT VGDDKYYFNP INGGAASIGE TIIDDKNYYF NQSGVLQTGV FSTEDGFKYF APANTLDENL EGE AIDFTG KLIIDENIYY FDDNYRGAVE WKELDGEMHY FSPETGKAFK GLNQIGDYKY YFNSDGVMQK GFVSINDNKH YFDD SGVMK VGYTEIDGKH FYFAENGEMQ IGVFNTEDGF KYFAHHNEDL GNEEGEEISY SGILNFNNKI YYFDDSFTAV VGWKD LEDG SKYYFDEDTA EAYIGLSLIN DGQYYFNDDG IMQVGFVTIN DKVFYFSDSG IIESGVQNID DNYFYIDDNG IVQIGV FDT SDGYKYFAPA NTVNDNIYGQ AVEYSGLVRV GEDVYYFGET YTIETGWIYD MENESDKYYF NPETKKACKG INLIDDI KY YFDEKGIMRT GLISFENNNY YFNENGEMQF GYINIEDKMF YFGEDGVMQI GVFNTPDGFK YFAHQNTLDE NFEGESIN Y TGWLDLDEKR YYFTDEYIAA TGSVIIDGEE YYFDPDTAQL VISE UniProtKB: Toxin B |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー
























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















