[日本語] English
 万見
万見- EMDB-23199: Generation of ordered protein assemblies using rigid three-body fusion -
+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-23199 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Generation of ordered protein assemblies using rigid three-body fusion | |||||||||
 マップデータ マップデータ | raw map | |||||||||
 試料 試料 |
| |||||||||
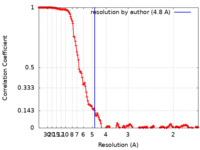
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.8 Å | |||||||||
 データ登録者 データ登録者 | Yao Q / Vulovic I / Baker D / Jensen G | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2021 ジャーナル: Proc Natl Acad Sci U S A / 年: 2021タイトル: Generation of ordered protein assemblies using rigid three-body fusion. 著者: Ivan Vulovic / Qing Yao / Young-Jun Park / Alexis Courbet / Andrew Norris / Florian Busch / Aniruddha Sahasrabuddhe / Hannes Merten / Danny D Sahtoe / George Ueda / Jorge A Fallas / Sara J ...著者: Ivan Vulovic / Qing Yao / Young-Jun Park / Alexis Courbet / Andrew Norris / Florian Busch / Aniruddha Sahasrabuddhe / Hannes Merten / Danny D Sahtoe / George Ueda / Jorge A Fallas / Sara J Weaver / Yang Hsia / Robert A Langan / Andreas Plückthun / Vicki H Wysocki / David Veesler / Grant J Jensen / David Baker /   要旨: Protein nanomaterial design is an emerging discipline with applications in medicine and beyond. A long-standing design approach uses genetic fusion to join protein homo-oligomer subunits via α- ...Protein nanomaterial design is an emerging discipline with applications in medicine and beyond. A long-standing design approach uses genetic fusion to join protein homo-oligomer subunits via α-helical linkers to form more complex symmetric assemblies, but this method is hampered by linker flexibility and a dearth of geometric solutions. Here, we describe a general computational method for rigidly fusing homo-oligomer and spacer building blocks to generate user-defined architectures that generates far more geometric solutions than previous approaches. The fusion junctions are then optimized using Rosetta to minimize flexibility. We apply this method to design and test 92 dihedral symmetric protein assemblies using a set of designed homodimers and repeat protein building blocks. Experimental validation by native mass spectrometry, small-angle X-ray scattering, and negative-stain single-particle electron microscopy confirms the assembly states for 11 designs. Most of these assemblies are constructed from designed ankyrin repeat proteins (DARPins), held in place on one end by α-helical fusion and on the other by a designed homodimer interface, and we explored their use for cryogenic electron microscopy (cryo-EM) structure determination by incorporating DARPin variants selected to bind targets of interest. Although the target resolution was limited by preferred orientation effects and small scaffold size, we found that the dual anchoring strategy reduced the flexibility of the target-DARPIN complex with respect to the overall assembly, suggesting that multipoint anchoring of binding domains could contribute to cryo-EM structure determination of small proteins. #1:  ジャーナル: Biorxiv / 年: 2020 ジャーナル: Biorxiv / 年: 2020タイトル: Generation of ordered protein assemblies using rigid three-body fusion 著者: Vulovic I / Yao Q / Park Y-J / Courbet A / Norris A / Busch F / Sahasrabuddhe A / Merten H / Sahtoe DD / Ueda G / Fallas JA / Weaver SJ / Hsia Y / Langan RA / Pluckthun A / Wysocki VH / ...著者: Vulovic I / Yao Q / Park Y-J / Courbet A / Norris A / Busch F / Sahasrabuddhe A / Merten H / Sahtoe DD / Ueda G / Fallas JA / Weaver SJ / Hsia Y / Langan RA / Pluckthun A / Wysocki VH / Veesler D / Jensen GJ / Baker D | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_23199.map.gz emd_23199.map.gz | 134.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-23199-v30.xml emd-23199-v30.xml emd-23199.xml emd-23199.xml | 18.6 KB 18.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_23199_fsc.xml emd_23199_fsc.xml | 14.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_23199.png emd_23199.png | 79 KB | ||
| マスクデータ |  emd_23199_msk_1.map emd_23199_msk_1.map | 274.6 MB |  マスクマップ マスクマップ | |
| その他 |  emd_23199_additional_1.map.gz emd_23199_additional_1.map.gz emd_23199_half_map_1.map.gz emd_23199_half_map_1.map.gz emd_23199_half_map_2.map.gz emd_23199_half_map_2.map.gz | 233.9 MB 254.6 MB 254.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-23199 http://ftp.pdbj.org/pub/emdb/structures/EMD-23199 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23199 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23199 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_23199_validation.pdf.gz emd_23199_validation.pdf.gz | 497.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_23199_full_validation.pdf.gz emd_23199_full_validation.pdf.gz | 496.9 KB | 表示 | |
| XML形式データ |  emd_23199_validation.xml.gz emd_23199_validation.xml.gz | 23 KB | 表示 | |
| CIF形式データ |  emd_23199_validation.cif.gz emd_23199_validation.cif.gz | 29.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23199 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23199 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23199 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23199 | HTTPS FTP |
-関連構造データ
| 関連構造データ | C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_23199.map.gz / 形式: CCP4 / 大きさ: 274.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_23199.map.gz / 形式: CCP4 / 大きさ: 274.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | raw map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.834 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_23199_msk_1.map emd_23199_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
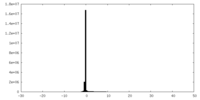
| 密度ヒストグラム |
-追加マップ: sharpened map
| ファイル | emd_23199_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | sharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
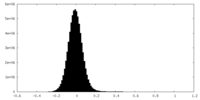
| 密度ヒストグラム |
-ハーフマップ: Half-map A
| ファイル | emd_23199_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
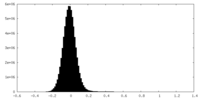
| 密度ヒストグラム |
-ハーフマップ: Half-map B
| ファイル | emd_23199_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
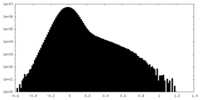
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Cryo-EM characterization of DARPin-grafted scaffold D2-1.4H with GFP
| 全体 | 名称: Cryo-EM characterization of DARPin-grafted scaffold D2-1.4H with GFP |
|---|---|
| 要素 |
|
-超分子 #1: Cryo-EM characterization of DARPin-grafted scaffold D2-1.4H with GFP
| 超分子 | 名称: Cryo-EM characterization of DARPin-grafted scaffold D2-1.4H with GFP タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 分子量 | 理論値: 310 KDa |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.5 mg/mL | ||||||
|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 / 構成要素:
| ||||||
| グリッド | モデル: Quantifoil / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE | ||||||
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 298 K / 装置: FEI VITROBOT MARK II |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 最大 デフォーカス(補正後): 2.9 µm / 最小 デフォーカス(補正後): 0.9 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.9 µm / 最小 デフォーカス(公称値): 0.9 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)