+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-23114 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the human 55S mitoribosome in complex with RRFmt and EF-G2mt | |||||||||
 マップデータ マップデータ | Cryo-EM structure of the human 55S mitoribosome in complex with RRFmt and EF-G2mt | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報mitochondrial translational termination / mitochondrial transcription / mitochondrial ribosome assembly / mitochondrial translational elongation / Mitochondrial translation elongation / Mitochondrial translation termination / translation release factor activity, codon nonspecific / Mitochondrial translation initiation / translation release factor activity / negative regulation of mitotic nuclear division ...mitochondrial translational termination / mitochondrial transcription / mitochondrial ribosome assembly / mitochondrial translational elongation / Mitochondrial translation elongation / Mitochondrial translation termination / translation release factor activity, codon nonspecific / Mitochondrial translation initiation / translation release factor activity / negative regulation of mitotic nuclear division / mitochondrial large ribosomal subunit / peptidyl-tRNA hydrolase / mitochondrial ribosome / mitochondrial small ribosomal subunit / 加水分解酵素; エステル加水分解酵素; 5'-リン酸モノエステル産生エンドリボヌクレアーゼ / ribosome disassembly / peptidyl-tRNA hydrolase activity / mitochondrial translation / apoptotic mitochondrial changes / ribosomal large subunit binding / positive regulation of proteolysis / ribosomal small subunit binding / anatomical structure morphogenesis / RNA processing / Mitochondrial protein degradation / rescue of stalled ribosome / cellular response to leukemia inhibitory factor / apoptotic signaling pathway / fibrillar center / cell junction / large ribosomal subunit / double-stranded RNA binding / regulation of translation / ribosomal small subunit assembly / small ribosomal subunit / small ribosomal subunit rRNA binding / large ribosomal subunit rRNA binding / endonuclease activity / nuclear membrane / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / tRNA binding / cell population proliferation / mitochondrial inner membrane / negative regulation of translation / rRNA binding / nuclear body / structural constituent of ribosome / ribosome / translation / mitochondrial matrix / ribonucleoprotein complex / protein domain specific binding / nucleotide binding / intracellular membrane-bounded organelle / mRNA binding / apoptotic process / GTP binding / positive regulation of DNA-templated transcription / nucleolus / mitochondrion / RNA binding / nucleoplasm / nucleus / plasma membrane / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.49 Å | |||||||||
 データ登録者 データ登録者 | Agrawal E / Koripella R | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Distinct mechanisms of the human mitoribosome recycling and antibiotic resistance. 著者: Ravi Kiran Koripella / Ayush Deep / Ekansh K Agrawal / Pooja Keshavan / Nilesh K Banavali / Rajendra K Agrawal /  要旨: Ribosomes are recycled for a new round of translation initiation by dissociation of ribosomal subunits, messenger RNA and transfer RNA from their translational post-termination complex. Here we ...Ribosomes are recycled for a new round of translation initiation by dissociation of ribosomal subunits, messenger RNA and transfer RNA from their translational post-termination complex. Here we present cryo-EM structures of the human 55S mitochondrial ribosome (mitoribosome) and the mitoribosomal large 39S subunit in complex with mitoribosome recycling factor (RRF) and a recycling-specific homolog of elongation factor G (EF-G2). These structures clarify an unusual role of a mitochondria-specific segment of RRF, identify the structural distinctions that confer functional specificity to EF-G2, and show that the deacylated tRNA remains with the dissociated 39S subunit, suggesting a distinct sequence of events in mitoribosome recycling. Furthermore, biochemical and structural analyses reveal that the molecular mechanism of antibiotic fusidic acid resistance for EF-G2 is markedly different from that of mitochondrial elongation factor EF-G1, suggesting that the two human EF-Gs have evolved diversely to negate the effect of a bacterial antibiotic. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_23114.map.gz emd_23114.map.gz | 226.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-23114-v30.xml emd-23114-v30.xml emd-23114.xml emd-23114.xml | 7.7 KB 7.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_23114.png emd_23114.png | 123.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-23114 http://ftp.pdbj.org/pub/emdb/structures/EMD-23114 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23114 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23114 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_23114_validation.pdf.gz emd_23114_validation.pdf.gz | 395.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_23114_full_validation.pdf.gz emd_23114_full_validation.pdf.gz | 395.5 KB | 表示 | |
| XML形式データ |  emd_23114_validation.xml.gz emd_23114_validation.xml.gz | 7.4 KB | 表示 | |
| CIF形式データ |  emd_23114_validation.cif.gz emd_23114_validation.cif.gz | 8.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23114 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23114 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23114 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23114 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7l08C  7l20C C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10703 (タイトル: Distinct mechanisms of the human mitoribosome recycling and antibiotic resistance EMPIAR-10703 (タイトル: Distinct mechanisms of the human mitoribosome recycling and antibiotic resistanceData size: 2.3 TB Data #1: Aligned single-frame particles of human mitochondrial 55S-EF-Gmt complex [picked particles - single frame - processed]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_23114.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_23114.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM structure of the human 55S mitoribosome in complex with RRFmt and EF-G2mt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.07325 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : 55S Mitochondrial Ribosome, mtEFG2, mtRRF
| 全体 | 名称: 55S Mitochondrial Ribosome, mtEFG2, mtRRF |
|---|---|
| 要素 |
|
-超分子 #1: 55S Mitochondrial Ribosome, mtEFG2, mtRRF
| 超分子 | 名称: 55S Mitochondrial Ribosome, mtEFG2, mtRRF / タイプ: complex / ID: 1 / 親要素: 0 / 詳細: 55S Mitochondrial Ribosome, mtEFG2, mtRRF |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: DIRECT ELECTRON DE-16 (4k x 4k) 平均電子線量: 70.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源: OTHER |
| 電子光学系 | 照射モード: OTHER / 撮影モード: OTHER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: EMDB MAP EMDB ID: 詳細: Structural insights into unique features of the human mitochondrial ribosome recycling |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.49 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 28929 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー



 UCSF Chimera
UCSF Chimera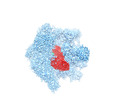
































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






















