+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-21204 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | BG505 SOSIP in complex with antibodies BG1 and 8ANC195 | ||||||||||||
 マップデータ マップデータ | CryoEM map of BG505 SOSIP in complex with BG1 and 8ANC195 | ||||||||||||
 試料 試料 |
| ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報IgD immunoglobulin complex / IgA immunoglobulin complex / IgM immunoglobulin complex / IgE immunoglobulin complex / CD22 mediated BCR regulation / IgG immunoglobulin complex / Fc epsilon receptor (FCERI) signaling / Classical antibody-mediated complement activation / Initial triggering of complement / immunoglobulin mediated immune response ...IgD immunoglobulin complex / IgA immunoglobulin complex / IgM immunoglobulin complex / IgE immunoglobulin complex / CD22 mediated BCR regulation / IgG immunoglobulin complex / Fc epsilon receptor (FCERI) signaling / Classical antibody-mediated complement activation / Initial triggering of complement / immunoglobulin mediated immune response / FCGR activation / Role of LAT2/NTAL/LAB on calcium mobilization / Role of phospholipids in phagocytosis / Scavenging of heme from plasma / antigen binding / positive regulation of plasma membrane raft polarization / positive regulation of receptor clustering / FCERI mediated Ca+2 mobilization / FCGR3A-mediated IL10 synthesis / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / Regulation of Complement cascade / host cell endosome membrane / Cell surface interactions at the vascular wall / B cell receptor signaling pathway / FCGR3A-mediated phagocytosis / FCERI mediated MAPK activation / Regulation of actin dynamics for phagocytic cup formation / FCERI mediated NF-kB activation / Immunoregulatory interactions between a Lymphoid and a non-Lymphoid cell / blood microparticle / clathrin-dependent endocytosis of virus by host cell / adaptive immune response / Potential therapeutics for SARS / viral protein processing / immune response / fusion of virus membrane with host plasma membrane / fusion of virus membrane with host endosome membrane / viral envelope / virion attachment to host cell / host cell plasma membrane / virion membrane / structural molecule activity / extracellular space / extracellular exosome / extracellular region / metal ion binding / identical protein binding / membrane / plasma membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) / Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) /  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
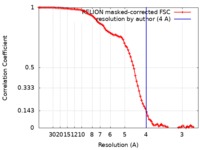
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.0 Å | ||||||||||||
 データ登録者 データ登録者 | Wang H / Bjorkman PJ | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2017 ジャーナル: Elife / 年: 2017タイトル: Asymmetric recognition of HIV-1 Envelope trimer by V1V2 loop-targeting antibodies. 著者: Haoqing Wang / Harry B Gristick / Louise Scharf / Anthony P West / Rachel P Galimidi / Michael S Seaman / Natalia T Freund / Michel C Nussenzweig / Pamela J Bjorkman /  要旨: The HIV-1 envelope (Env) glycoprotein binds to host cell receptors to mediate membrane fusion. The prefusion Env trimer is stabilized by V1V2 loops that interact at the trimer apex. Broadly ...The HIV-1 envelope (Env) glycoprotein binds to host cell receptors to mediate membrane fusion. The prefusion Env trimer is stabilized by V1V2 loops that interact at the trimer apex. Broadly neutralizing antibodies (bNAbs) against V1V2 loops, exemplified by PG9, bind asymmetrically as a single Fab to the apex of the symmetric Env trimer using a protruding CDRH3 to penetrate the Env glycan shield. Here we characterized a distinct mode of V1V2 epitope recognition by the new bNAb BG1 in which two Fabs bind asymmetrically per Env trimer using a compact CDRH3. Comparisons between cryo-EM structures of Env trimer complexed with BG1 (6.2 Å resolution) and PG9 (11.5 Å resolution) revealed a new V1V2-targeting strategy by BG1. Analyses of the EM structures provided information relevant to vaccine design including molecular details for different modes of asymmetric recognition of Env trimer and a binding model for BG1 recognition of V1V2 involving glycan flexibility. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_21204.map.gz emd_21204.map.gz | 7.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-21204-v30.xml emd-21204-v30.xml emd-21204.xml emd-21204.xml | 11 KB 11 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_21204_fsc.xml emd_21204_fsc.xml | 9.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_21204.png emd_21204.png | 116.8 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-21204 http://ftp.pdbj.org/pub/emdb/structures/EMD-21204 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21204 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21204 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_21204_validation.pdf.gz emd_21204_validation.pdf.gz | 77.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_21204_full_validation.pdf.gz emd_21204_full_validation.pdf.gz | 77 KB | 表示 | |
| XML形式データ |  emd_21204_validation.xml.gz emd_21204_validation.xml.gz | 492 B | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21204 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21204 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21204 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21204 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_21204.map.gz / 形式: CCP4 / 大きさ: 67 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_21204.map.gz / 形式: CCP4 / 大きさ: 67 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM map of BG505 SOSIP in complex with BG1 and 8ANC195 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.35 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : BG505 SOSIP-BG1-8ANC195 complex
| 全体 | 名称: BG505 SOSIP-BG1-8ANC195 complex |
|---|---|
| 要素 |
|
-超分子 #1: BG505 SOSIP-BG1-8ANC195 complex
| 超分子 | 名称: BG505 SOSIP-BG1-8ANC195 complex / タイプ: complex / ID: 1 / 親要素: 0 |
|---|
-超分子 #2: BG505 SOSIP
| 超分子 | 名称: BG505 SOSIP / タイプ: complex / ID: 2 / 親要素: 1 / 詳細: HIV envelope glycoprotein |
|---|---|
| 由来(天然) | 生物種:   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-超分子 #3: BG1
| 超分子 | 名称: BG1 / タイプ: complex / ID: 3 / 親要素: 1 / 詳細: patient-derived broadly neutralizing antibody |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-超分子 #4: 8ANC195
| 超分子 | 名称: 8ANC195 / タイプ: complex / ID: 4 / 親要素: 1 / 詳細: patient-derived broadly neutralizing antibody |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| グリッド | 詳細: unspecified |
| 凍結 | 凍結剤: ETHANE-PROPANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / 平均電子線量: 80.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: RIGID BODY FIT |
|---|
 ムービー
ムービー コントローラー
コントローラー







































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)