+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-1898 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Reconstruction of the 3D model of AMPK trimer in ATP binding state. | |||||||||
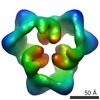
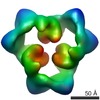
 マップデータ マップデータ | This is an image of a surface-rendered side-view of AMP-activated protein kinase bound with ATP. | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 20.0 Å | |||||||||
 データ登録者 データ登録者 | Zhu L / Chen L / Zhou XM / Zhang YY / Zhang YJ / Zhao J / Ji SR / Wu JW / Wu Y | |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2011 ジャーナル: Structure / 年: 2011タイトル: Structural insights into the architecture and allostery of full-length AMP-activated protein kinase. 著者: Li Zhu / Lei Chen / Xiao-Ming Zhou / Yuan-Yuan Zhang / Yi-Jiong Zhang / Jing Zhao / Shang-Rong Ji / Jia-Wei Wu / Yi Wu /  要旨: AMP-activated protein kinase (AMPK) is a heterotrimeric complex composed of α catalytic subunit, β scaffolding subunit, and γ regulatory subunit with critical roles in maintaining cellular energy ...AMP-activated protein kinase (AMPK) is a heterotrimeric complex composed of α catalytic subunit, β scaffolding subunit, and γ regulatory subunit with critical roles in maintaining cellular energy homeostasis. However, the molecular architecture of the intact complex and the allostery associated with the adenosine binding-induced regulation of kinase activity remain unclear. Here, we determine the three-dimensional reconstruction and subunit organization of the full-length rat AMPK (α1β1γ1) through single-particle electron-microscopy. By comparing the structures of AMPK in ATP- and AMP-bound states, we are able to visualize the sequential conformational changes underlying kinase activation that transmits from the adenosine binding sites in the γ subunit to the kinase domain of the α subunit. These results not only make substantial revision to the current model of AMPK assembly, but also highlight a central role of the linker sequence of the α subunit in mediating the allostery of AMPK. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_1898.map.gz emd_1898.map.gz | 1.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-1898-v30.xml emd-1898-v30.xml emd-1898.xml emd-1898.xml | 10.7 KB 10.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_1898.png emd_1898.png | 133.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-1898 http://ftp.pdbj.org/pub/emdb/structures/EMD-1898 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1898 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1898 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_1898_validation.pdf.gz emd_1898_validation.pdf.gz | 197.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_1898_full_validation.pdf.gz emd_1898_full_validation.pdf.gz | 197 KB | 表示 | |
| XML形式データ |  emd_1898_validation.xml.gz emd_1898_validation.xml.gz | 5.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1898 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1898 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1898 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1898 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_1898.map.gz / 形式: CCP4 / 大きさ: 1.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_1898.map.gz / 形式: CCP4 / 大きさ: 1.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | This is an image of a surface-rendered side-view of AMP-activated protein kinase bound with ATP. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 4.23 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Full-Length Rat AMP-Activated Protein Kinase
| 全体 | 名称: Full-Length Rat AMP-Activated Protein Kinase |
|---|---|
| 要素 |
|
-超分子 #1000: Full-Length Rat AMP-Activated Protein Kinase
| 超分子 | 名称: Full-Length Rat AMP-Activated Protein Kinase / タイプ: sample / ID: 1000 / 集合状態: homotrimer / Number unique components: 1 |
|---|---|
| 分子量 | 実験値: 390 KDa / 理論値: 390 KDa |
-分子 #1: Mammalian AMP-Activated Protein Kinase
| 分子 | 名称: Mammalian AMP-Activated Protein Kinase / タイプ: protein_or_peptide / ID: 1 / Name.synonym: AMPK / コピー数: 3 / 集合状態: Homotrimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 実験値: 390 KDa / 理論値: 390 KDa |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.15 mg/mL |
|---|---|
| 緩衝液 | pH: 6.8 / 詳細: 10mM Tris,15mM NaCl, 1mM TCEP,1.2mM MgCl2 |
| 染色 | タイプ: NEGATIVE 詳細: Grids with adsorbed protein floated on 1% w/v uranyl acetate for 30 seconds. |
| グリッド | 詳細: 300 mesh copper EM grid |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI 20 |
|---|---|
| アライメント法 | Legacy - 非点収差: objective lens astigmatism was corrected at 100,000 times magnification |
| 撮影 | カテゴリ: FILM / フィルム・検出器のモデル: KODAK SO-163 FILM / デジタル化 - スキャナー: OTHER / デジタル化 - サンプリング間隔: 21.17 µm / 実像数: 180 / 平均電子線量: 18 e/Å2 / ビット/ピクセル: 16 |
| Tilt angle max | 0 |
| 電子線 | 加速電圧: 200 kV / 電子線源: LAB6 |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 最大 デフォーカス(公称値): 1.7 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 50000 |
| 試料ステージ | 試料ホルダー: Single tilt / 試料ホルダーモデル: OTHER / Tilt angle min: -45 |
- 画像解析
画像解析
| 詳細 | The particle pairs were extracted using WEB program with a box size of 72 pixels. |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C3 (3回回転対称) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 20.0 Å / 解像度の算出法: FSC 0.5 CUT-OFF / ソフトウェア - 名称: SPIDER 詳細: High-quality classes without significant differences in initial reconstructions were merged for calculating new volumes. 使用した粒子像数: 7874 |
| 最終 角度割当 | 詳細: SPIDER:theta 45 degrees |
| 最終 2次元分類 | クラス数: 10 |
 ムービー
ムービー コントローラー
コントローラー



 UCSF Chimera
UCSF Chimera




 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)