+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-1779 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | EM structure of bacteriophage SPP1 distal tail protein (GP 19.1): a baseplate hub paradigm in gram positive infecting phages | |||||||||
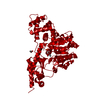
 マップデータ マップデータ | EM map of Dit (GP19.1) from SPP1 Bacteriophage | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Dit / GP 19.1 / SPP1 / Bacteriophage | |||||||||
| 生物種 |  Bacillus phage SPP1 (ファージ) Bacillus phage SPP1 (ファージ) | |||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 21.5 Å | |||||||||
 データ登録者 データ登録者 | Veesler D / Robin G / Lichiere J / Auzat I / Tavares P / Bron P / Campanacci V / Cambillau C | |||||||||
 引用 引用 |  ジャーナル: J Biol Chem / 年: 2010 ジャーナル: J Biol Chem / 年: 2010タイトル: Crystal structure of bacteriophage SPP1 distal tail protein (gp19.1): a baseplate hub paradigm in gram-positive infecting phages. 著者: David Veesler / Gautier Robin / Julie Lichière / Isabelle Auzat / Paulo Tavares / Patrick Bron / Valérie Campanacci / Christian Cambillau /  要旨: Siphophage SPP1 infects the gram-positive bacterium Bacillus subtilis using its long non-contractile tail and tail-tip. Electron microscopy (EM) previously allowed a low resolution assignment of most ...Siphophage SPP1 infects the gram-positive bacterium Bacillus subtilis using its long non-contractile tail and tail-tip. Electron microscopy (EM) previously allowed a low resolution assignment of most orf products belonging to these regions. We report here the structure of the SPP1 distal tail protein (Dit, gp19.1). The combination of x-ray crystallography, EM, and light scattering established that Dit is a back-to-back dimer of hexamers. However, Dit fitting in the virion EM maps was only possible with a hexamer located between the tail-tube and the tail-tip. Structure comparison revealed high similarity between Dit and a central component of lactophage baseplates. Sequence similarity search expanded its relatedness to several phage proteins, suggesting that Dit is a docking platform for the tail adsorption apparatus in Siphoviridae infecting gram-positive bacteria and that its architecture is a paradigm for these hub proteins. Dit structural similarity extends also to non-contractile and contractile phage tail proteins (gpV(N) and XkdM) as well as to components of the bacterial type 6 secretion system, supporting an evolutionary connection between all these devices. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_1779.map.gz emd_1779.map.gz | 7.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-1779-v30.xml emd-1779-v30.xml emd-1779.xml emd-1779.xml | 9.4 KB 9.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd1779.jpg emd1779.jpg | 95.9 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-1779 http://ftp.pdbj.org/pub/emdb/structures/EMD-1779 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1779 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1779 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_1779_validation.pdf.gz emd_1779_validation.pdf.gz | 211.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_1779_full_validation.pdf.gz emd_1779_full_validation.pdf.gz | 210.6 KB | 表示 | |
| XML形式データ |  emd_1779_validation.xml.gz emd_1779_validation.xml.gz | 5.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1779 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1779 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1779 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1779 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_1779.map.gz / 形式: CCP4 / 大きさ: 7.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_1779.map.gz / 形式: CCP4 / 大きさ: 7.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | EM map of Dit (GP19.1) from SPP1 Bacteriophage | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.19 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : GP 19.1 protein from B. subtilis phage SPP1 Bacteriophage
| 全体 | 名称: GP 19.1 protein from B. subtilis phage SPP1 Bacteriophage |
|---|---|
| 要素 |
|
-超分子 #1000: GP 19.1 protein from B. subtilis phage SPP1 Bacteriophage
| 超分子 | 名称: GP 19.1 protein from B. subtilis phage SPP1 Bacteriophage タイプ: sample / ID: 1000 / 詳細: The sample was monodisperse / 集合状態: Dodecameric / Number unique components: 1 |
|---|---|
| 分子量 | 実験値: 325.629 KDa / 理論値: 28.489 KDa 手法: Molar mass and hydrodynamic radius determination by SEC, MALS,UV,QELS and RI. |
-分子 #1: GP19.1
| 分子 | 名称: GP19.1 / タイプ: protein_or_peptide / ID: 1 / Name.synonym: Dit / コピー数: 12 / 集合状態: Dodecameric / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Bacillus phage SPP1 (ファージ) Bacillus phage SPP1 (ファージ) |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.010 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 / 詳細: 10 mM HEPES, 150 mM NaCl |
| 染色 | タイプ: NEGATIVE 詳細: 3 microLitres of freshly prepared protein were applied on a glow-discharged carbon-coated grid. The excess of Dit solution was blotted and 4 microliters of 1% Uranyl- Acetate was applied ...詳細: 3 microLitres of freshly prepared protein were applied on a glow-discharged carbon-coated grid. The excess of Dit solution was blotted and 4 microliters of 1% Uranyl- Acetate was applied twice on the grid and incubated for 1 min. Grids were then dried and kept in a desiccator cabinet until use |
| グリッド | 詳細: 400-Mesh Carbon-Coated Copper Grid |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 2200FS |
|---|---|
| 特殊光学系 | エネルギーフィルター - エネルギー下限: 0.0 eV エネルギーフィルター - エネルギー上限: 20.0 eV |
| 詳細 | Low-dose imaging |
| 撮影 | カテゴリ: FILM / フィルム・検出器のモデル: KODAK SO-163 FILM デジタル化 - スキャナー: NIKON SUPER COOLSCAN 9000 デジタル化 - サンプリング間隔: 10 µm / 実像数: 8 / 平均電子線量: 18 e/Å2 / ビット/ピクセル: 8 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 45710 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.2 µm / 最小 デフォーカス(公称値): 0.3 µm / 倍率(公称値): 50000 |
| 試料ステージ | 試料ホルダー: Eucentric / 試料ホルダーモデル: JEOL |
- 画像解析
画像解析
| CTF補正 | 詳細: Each particle |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: D6 (2回x6回 2面回転対称) アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 21.5 Å / 解像度の算出法: FSC 0.5 CUT-OFF / ソフトウェア - 名称: IMAGIC V / 使用した粒子像数: 9027 |
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















