+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CAND1-SCF-SKP2 with substrate p27-CKSHS1-CyclinA-CDK2, CAND1 rolling SCF engaged | |||||||||
 マップデータ マップデータ | relion postprocess | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
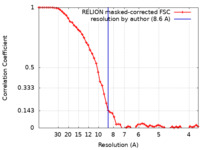
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 8.6 Å | |||||||||
 データ登録者 データ登録者 | Baek K / Schulman BA | |||||||||
| 資金援助 |  ドイツ, European Union, 2件 ドイツ, European Union, 2件
| |||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2023 ジャーナル: Cell / 年: 2023タイトル: Systemwide disassembly and assembly of SCF ubiquitin ligase complexes. 著者: Kheewoong Baek / Daniel C Scott / Lukas T Henneberg / Moeko T King / Matthias Mann / Brenda A Schulman /   要旨: Cells respond to environmental cues by remodeling their inventories of multiprotein complexes. Cellular repertoires of SCF (SKP1-CUL1-F box protein) ubiquitin ligase complexes, which mediate much ...Cells respond to environmental cues by remodeling their inventories of multiprotein complexes. Cellular repertoires of SCF (SKP1-CUL1-F box protein) ubiquitin ligase complexes, which mediate much protein degradation, require CAND1 to distribute the limiting CUL1 subunit across the family of ∼70 different F box proteins. Yet, how a single factor coordinately assembles numerous distinct multiprotein complexes remains unknown. We obtained cryo-EM structures of CAND1-bound SCF complexes in multiple states and correlated mutational effects on structures, biochemistry, and cellular assays. The data suggest that CAND1 clasps idling catalytic domains of an inactive SCF, rolls around, and allosterically rocks and destabilizes the SCF. New SCF production proceeds in reverse, through SKP1-F box allosterically destabilizing CAND1. The CAND1-SCF conformational ensemble recycles CUL1 from inactive complexes, fueling mixing and matching of SCF parts for E3 activation in response to substrate availability. Our data reveal biogenesis of a predominant family of E3 ligases, and the molecular basis for systemwide multiprotein complex assembly. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16621.map.gz emd_16621.map.gz | 2.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16621-v30.xml emd-16621-v30.xml emd-16621.xml emd-16621.xml | 13.9 KB 13.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16621_fsc.xml emd_16621_fsc.xml | 5.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16621.png emd_16621.png | 120.3 KB | ||
| マスクデータ |  emd_16621_msk_1.map emd_16621_msk_1.map | 15.6 MB |  マスクマップ マスクマップ | |
| その他 |  emd_16621_additional_1.map.gz emd_16621_additional_1.map.gz emd_16621_half_map_1.map.gz emd_16621_half_map_1.map.gz emd_16621_half_map_2.map.gz emd_16621_half_map_2.map.gz | 11.9 MB 11.9 MB 11.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16621 http://ftp.pdbj.org/pub/emdb/structures/EMD-16621 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16621 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16621 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_16621_validation.pdf.gz emd_16621_validation.pdf.gz | 722 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_16621_full_validation.pdf.gz emd_16621_full_validation.pdf.gz | 721.6 KB | 表示 | |
| XML形式データ |  emd_16621_validation.xml.gz emd_16621_validation.xml.gz | 11.3 KB | 表示 | |
| CIF形式データ |  emd_16621_validation.cif.gz emd_16621_validation.cif.gz | 15.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16621 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16621 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16621 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16621 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16621.map.gz / 形式: CCP4 / 大きさ: 15.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16621.map.gz / 形式: CCP4 / 大きさ: 15.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | relion postprocess | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.885 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_16621_msk_1.map emd_16621_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: 3d refinement
| ファイル | emd_16621_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 3d refinement | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: halfmap2
| ファイル | emd_16621_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | halfmap2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: halfmap1
| ファイル | emd_16621_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | halfmap1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : CAND1-SCF-SKP2 with substrate p27-CKSHS1-CyclinA-CDK2, CAND1 roll...
| 全体 | 名称: CAND1-SCF-SKP2 with substrate p27-CKSHS1-CyclinA-CDK2, CAND1 rolling SCF engaged |
|---|---|
| 要素 |
|
-超分子 #1: CAND1-SCF-SKP2 with substrate p27-CKSHS1-CyclinA-CDK2, CAND1 roll...
| 超分子 | 名称: CAND1-SCF-SKP2 with substrate p27-CKSHS1-CyclinA-CDK2, CAND1 rolling SCF engaged タイプ: complex / ID: 1 / キメラ: Yes / 親要素: 0 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE-PROPANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.5 µm |
 ムービー
ムービー コントローラー
コントローラー
























































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)