+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-13734 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | wt HBc capsid like particles in complex with inhibitory peptide SLLGRM and Triton X-100 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | wt HBc capsid / Triton X-100 / inhibitory peptide SLLGRM / Cryo-EM / Hepatitis B virus / VIRAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報microtubule-dependent intracellular transport of viral material towards nucleus / T=4 icosahedral viral capsid / viral penetration into host nucleus / host cell / host cell cytoplasm / symbiont entry into host cell / structural molecule activity / DNA binding / RNA binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Hepatitis B virus ayw/France/Tiollais/1979 (ウイルス) / Hepatitis B virus ayw/France/Tiollais/1979 (ウイルス) /  Hepatitis B virus genotype D subtype ayw (isolate France/Tiollais/1979) (ウイルス) / Hepatitis B virus genotype D subtype ayw (isolate France/Tiollais/1979) (ウイルス) /  | |||||||||
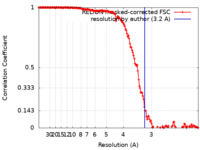
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Makbul C / Boettcher B | |||||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| |||||||||
 引用 引用 |  ジャーナル: Viruses / 年: 2021 ジャーナル: Viruses / 年: 2021タイトル: Binding of a Pocket Factor to Hepatitis B Virus Capsids Changes the Rotamer Conformation of Phenylalanine 97. 著者: Cihan Makbul / Christian Kraft / Matthias Grießmann / Tim Rasmussen / Kilian Katzenberger / Melina Lappe / Paul Pfarr / Cato Stoffer / Mara Stöhr / Anna-Maria Wandinger / Bettina Böttcher /  要旨: (1) Background: During maturation of the Hepatitis B virus, a viral polymerase inside the capsid transcribes a pre-genomic RNA into a partly double stranded DNA-genome. This is followed by ...(1) Background: During maturation of the Hepatitis B virus, a viral polymerase inside the capsid transcribes a pre-genomic RNA into a partly double stranded DNA-genome. This is followed by envelopment with surface proteins inserted into a membrane. Envelopment is hypothetically regulated by a structural signal that reports the maturation state of the genome. NMR data suggest that such a signal can be mimicked by the binding of the detergent Triton X 100 to hydrophobic pockets in the capsid spikes. (2) Methods: We have used electron cryo-microscopy and image processing to elucidate the structural changes that are concomitant with the binding of Triton X 100. (3) Results: Our maps show that Triton X 100 binds with its hydrophobic head group inside the pocket. The hydrophilic tail delineates the outside of the spike and is coordinated via Lys-96. The binding of Triton X 100 changes the rotamer conformation of Phe-97 in helix 4, which enables a π-stacking interaction with Trp-62 in helix 3. Similar changes occur in mutants with low secretion phenotypes (P5T and L60V) and in a mutant with a pre-mature secretion phenotype (F97L). (4) Conclusion: Binding of Triton X 100 is unlikely to mimic structural maturation because mutants with different secretion phenotypes show similar structural responses. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_13734.map.gz emd_13734.map.gz | 228.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-13734-v30.xml emd-13734-v30.xml emd-13734.xml emd-13734.xml | 17.5 KB 17.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_13734_fsc.xml emd_13734_fsc.xml | 15.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_13734.png emd_13734.png | 105 KB | ||
| Filedesc metadata |  emd-13734.cif.gz emd-13734.cif.gz | 6.1 KB | ||
| その他 |  emd_13734_half_map_1.map.gz emd_13734_half_map_1.map.gz emd_13734_half_map_2.map.gz emd_13734_half_map_2.map.gz | 260.4 MB 260.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-13734 http://ftp.pdbj.org/pub/emdb/structures/EMD-13734 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13734 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13734 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_13734_validation.pdf.gz emd_13734_validation.pdf.gz | 1.2 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_13734_full_validation.pdf.gz emd_13734_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  emd_13734_validation.xml.gz emd_13734_validation.xml.gz | 23.9 KB | 表示 | |
| CIF形式データ |  emd_13734_validation.cif.gz emd_13734_validation.cif.gz | 30.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13734 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13734 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13734 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13734 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_13734.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_13734.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.0635 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
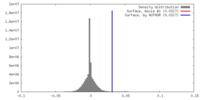
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-ハーフマップ: #2
| ファイル | emd_13734_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
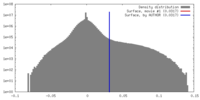
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_13734_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
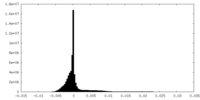
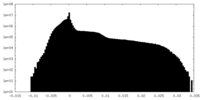
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : wt HBc copurified with Triton X-100 and SLLGRM
| 全体 | 名称: wt HBc copurified with Triton X-100 and SLLGRM |
|---|---|
| 要素 |
|
-超分子 #1: wt HBc copurified with Triton X-100 and SLLGRM
| 超分子 | 名称: wt HBc copurified with Triton X-100 and SLLGRM / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Hepatitis B virus ayw/France/Tiollais/1979 (ウイルス) Hepatitis B virus ayw/France/Tiollais/1979 (ウイルス) |
-分子 #1: Capsid protein
| 分子 | 名称: Capsid protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Hepatitis B virus genotype D subtype ayw (isolate France/Tiollais/1979) (ウイルス) Hepatitis B virus genotype D subtype ayw (isolate France/Tiollais/1979) (ウイルス)株: isolate France/Tiollais/1979 |
| 分子量 | 理論値: 21.146217 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDIDPYKEFG ATVELLSFLP SDFFPSVRDL LDTASALYRE ALESPEHCSP HHTALRQAIL CWGELMTLAT WVGVNLEDPA SRDLVVSYV NTNMGLKFRQ LLWFHISCLT FGRETVIEYL VSFGVWIRTP PAYRPPNAPI LSTLPETTVV RRRGRSPRRR T PSPRRRRS QSPRRRRSQS RESQC UniProtKB: Capsid protein |
-分子 #2: SLLGRM, modelled as poly-A,SLLGRM, modelled as poly-A
| 分子 | 名称: SLLGRM, modelled as poly-A,SLLGRM, modelled as poly-A タイプ: protein_or_peptide / ID: 2 詳細: inhibitory peptide of envelopment,inhibitory peptide of envelopment コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 1.017269 KDa |
| 配列 | 文字列: (UNK)(UNK)(UNK)(UNK)SLLGRM |
-分子 #3: FRAGMENT OF TRITON X-100
| 分子 | 名称: FRAGMENT OF TRITON X-100 / タイプ: ligand / ID: 3 / コピー数: 4 / 式: TRT |
|---|---|
| 分子量 | 理論値: 352.508 Da |
| Chemical component information |  ChemComp-TRT: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR / 前処理 - 気圧: 0.029 kPa |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)