+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10425 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the five-fold capsomer of the dArc1 capsid | ||||||||||||
 マップデータ マップデータ | dArc1 five-fold capsomer | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | dArc / Gag / Virus / VLP / VIRUS LIKE PARTICLE | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報postsynapse of neuromuscular junction / muscle system process / behavioral response to starvation / virus-like capsid / vesicle-mediated intercellular transport / regulation of neuronal synaptic plasticity / mRNA transport / sarcomere / extracellular vesicle / mRNA binding ...postsynapse of neuromuscular junction / muscle system process / behavioral response to starvation / virus-like capsid / vesicle-mediated intercellular transport / regulation of neuronal synaptic plasticity / mRNA transport / sarcomere / extracellular vesicle / mRNA binding / synapse / structural molecule activity / identical protein binding / membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.8 Å | ||||||||||||
 データ登録者 データ登録者 | Erlendsson S / Morado DR | ||||||||||||
| 資金援助 |  デンマーク, デンマーク,  米国, 米国,  英国, 3件 英国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Neurosci / 年: 2020 ジャーナル: Nat Neurosci / 年: 2020タイトル: Structures of virus-like capsids formed by the Drosophila neuronal Arc proteins. 著者: Simon Erlendsson / Dustin R Morado / Harrison B Cullen / Cedric Feschotte / Jason D Shepherd / John A G Briggs /   要旨: Arc, a neuronal gene that is critical for synaptic plasticity, originated through the domestication of retrotransposon Gag genes and mediates intercellular messenger RNA transfer. We report high- ...Arc, a neuronal gene that is critical for synaptic plasticity, originated through the domestication of retrotransposon Gag genes and mediates intercellular messenger RNA transfer. We report high-resolution structures of retrovirus-like capsids formed by Drosophila dArc1 and dArc2 that have surface spikes and putative internal RNA-binding domains. These data demonstrate that virus-like capsid-forming properties of Arc are evolutionarily conserved and provide a structural basis for understanding their function in intercellular communication. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10425.map.gz emd_10425.map.gz | 8.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10425-v30.xml emd-10425-v30.xml emd-10425.xml emd-10425.xml | 17.1 KB 17.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_10425.png emd_10425.png | 88.6 KB | ||
| Filedesc metadata |  emd-10425.cif.gz emd-10425.cif.gz | 6.3 KB | ||
| その他 |  emd_10425_additional.map.gz emd_10425_additional.map.gz | 9.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10425 http://ftp.pdbj.org/pub/emdb/structures/EMD-10425 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10425 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10425 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10425_validation.pdf.gz emd_10425_validation.pdf.gz | 510.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10425_full_validation.pdf.gz emd_10425_full_validation.pdf.gz | 510.1 KB | 表示 | |
| XML形式データ |  emd_10425_validation.xml.gz emd_10425_validation.xml.gz | 5.4 KB | 表示 | |
| CIF形式データ |  emd_10425_validation.cif.gz emd_10425_validation.cif.gz | 6.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10425 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10425 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10425 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10425 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10425.map.gz / 形式: CCP4 / 大きさ: 12.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10425.map.gz / 形式: CCP4 / 大きさ: 12.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | dArc1 five-fold capsomer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.211 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
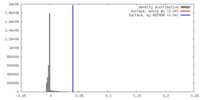
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: dArc1 five-fold capsomer unsharpened
| ファイル | emd_10425_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | dArc1 five-fold capsomer unsharpened | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
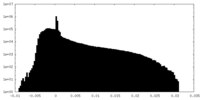
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : dArc1 capsids
| 全体 | 名称: dArc1 capsids |
|---|---|
| 要素 |
|
-超分子 #1: dArc1 capsids
| 超分子 | 名称: dArc1 capsids / タイプ: cell / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: The five-fold dArc1 capsomer map is generated by symmetry expansion, sub-boxing and local refinement. |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Activity-regulated cytoskeleton associated protein 1
| 分子 | 名称: Activity-regulated cytoskeleton associated protein 1 タイプ: protein_or_peptide / ID: 1 / コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 28.921201 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAQLTQMTNE QLRELIEAVR AAAVGAAGSA AAAGGADASR GKGNFSACTH SFGGTRDHDV VEEFIGNIET YKDVEGISDE NALKGISLL FYGMASTWWQ GVRKEATTWK EAIALIREHF SPTKPAYQIY MEFFQNKQDD HDPIDTFVIQ KRALLAQLPS G RHDEETEL ...文字列: MAQLTQMTNE QLRELIEAVR AAAVGAAGSA AAAGGADASR GKGNFSACTH SFGGTRDHDV VEEFIGNIET YKDVEGISDE NALKGISLL FYGMASTWWQ GVRKEATTWK EAIALIREHF SPTKPAYQIY MEFFQNKQDD HDPIDTFVIQ KRALLAQLPS G RHDEETEL DLLFGLLNIK YRKHISRHSV HTFKDLLEQG RIIEHNNQED EEQLATAKNT RGSKRTTRCT YCSFRGHTFD NC RKRQKDR QEEQHEE UniProtKB: Activity-regulated cytoskeleton associated protein 1 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| |||||||||||||||
| グリッド | モデル: Homemade / 材質: COPPER / メッシュ: 300 / 支持フィルム - #0 - Film type ID: 1 / 支持フィルム - #0 - 材質: CARBON / 支持フィルム - #0 - トポロジー: LACEY / 支持フィルム - #1 - Film type ID: 2 / 支持フィルム - #1 - 材質: CARBON / 支持フィルム - #1 - トポロジー: CONTINUOUS / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 45 sec. / 前処理 - 雰囲気: AIR / 前処理 - 気圧: 0.039 kPa / 詳細: 25 mA | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 278 K / 装置: FEI VITROBOT MARK IV | |||||||||||||||
| 詳細 | dArc1 capsids |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / デジタル化 - 画像ごとのフレーム数: 1-75 / 平均電子線量: 35.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)