+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-1025 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Microscopic evidence for a minus-end-directed power stroke in the kinesin motor ncd. | |||||||||
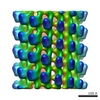
 マップデータ マップデータ | helical reconstruction of SH3 tagged Ncd296 motor fragment no nucleotide state | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |   | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / ネガティブ染色法 | |||||||||
 データ登録者 データ登録者 | Wendt TG | |||||||||
 引用 引用 |  ジャーナル: EMBO J / 年: 2002 ジャーナル: EMBO J / 年: 2002タイトル: Microscopic evidence for a minus-end-directed power stroke in the kinesin motor ncd. 著者: Thomas G Wendt / Niels Volkmann / Georgios Skiniotis / Kenneth N Goldie / Jens Müller / Eckhard Mandelkow / Andreas Hoenger /  要旨: We used cryo-electron microscopy and image reconstruction to investigate the structure and microtubule-binding configurations of dimeric non-claret disjunctional (ncd) motor domains under various ...We used cryo-electron microscopy and image reconstruction to investigate the structure and microtubule-binding configurations of dimeric non-claret disjunctional (ncd) motor domains under various nucleotide conditions, and applied molecular docking using ncd's dimeric X-ray structure to generate a mechanistic model for force transduction. To visualize the alpha-helical coiled-coil neck better, we engineered an SH3 domain to the N-terminal end of our ncd construct (296-700). Ncd exhibits strikingly different nucleotide-dependent three-dimensional conformations and microtubule-binding patterns from those of conventional kinesin. In the absence of nucleotide, the neck adapts a configuration close to that found in the X-ray structure with stable interactions between the neck and motor core domain. Minus-end-directed movement is based mainly on two key events: (i) the stable neck-core interactions in ncd generate a binding geometry between motor and microtubule which places the motor ahead of its cargo in the minus-end direction; and (ii) after the uptake of ATP, the two heads rearrange their position relative to each other in a way that promotes a swing of the neck in the minus-end direction. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_1025.map.gz emd_1025.map.gz | 547.8 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-1025-v30.xml emd-1025-v30.xml emd-1025.xml emd-1025.xml | 10.3 KB 10.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  1025.gif 1025.gif | 27.9 KB | ||
| Filedesc layerLines |  emd_1025_ll.cif.gz emd_1025_ll.cif.gz | 12 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-1025 http://ftp.pdbj.org/pub/emdb/structures/EMD-1025 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1025 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1025 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_1025_validation.pdf.gz emd_1025_validation.pdf.gz | 294 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_1025_full_validation.pdf.gz emd_1025_full_validation.pdf.gz | 293.2 KB | 表示 | |
| XML形式データ |  emd_1025_validation.xml.gz emd_1025_validation.xml.gz | 3.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1025 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1025 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1025 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1025 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_1025.map.gz / 形式: CCP4 / 大きさ: 2.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_1025.map.gz / 形式: CCP4 / 大きさ: 2.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | helical reconstruction of SH3 tagged Ncd296 motor fragment no nucleotide state | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 5.53 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : SH3 tagged Ncd296 motor fragment from Drosophila Melanogaster no ...
| 全体 | 名称: SH3 tagged Ncd296 motor fragment from Drosophila Melanogaster no nucleotide state |
|---|---|
| 要素 |
|
-超分子 #1000: SH3 tagged Ncd296 motor fragment from Drosophila Melanogaster no ...
| 超分子 | 名称: SH3 tagged Ncd296 motor fragment from Drosophila Melanogaster no nucleotide state タイプ: sample / ID: 1000 / 集合状態: SH3ncd forms a dimer / Number unique components: 2 |
|---|
-分子 #1: SH3 tagged Ncd296 dimer
| 分子 | 名称: SH3 tagged Ncd296 dimer / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 集合状態: SH3ncd296 forms a dimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 実験値: 106.8 KDa |
| 組換発現 | 生物種:  |
-分子 #2: tubulin dimer
| 分子 | 名称: tubulin dimer / タイプ: protein_or_peptide / ID: 2 / Name.synonym: alpha beta tubulin 詳細: bovine tubulin was purchased from Cytoskeleton Inc. (Denver,CO) 集合状態: polymer of alpha beta dimers / 組換発現: No / データベース: NCBI |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 実験値: 100 KDa |
-実験情報
-構造解析
| 手法 | ネガティブ染色法, クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 2.45 mg/mL |
|---|---|
| 緩衝液 | pH: 6.8 / 詳細: 80mM PIPES, 2mM MgCl2 |
| 染色 | タイプ: NEGATIVE / 詳細: plunge-frozen in liquid ethane |
| グリッド | 詳細: quantifoil holey grids |
| 凍結 | 凍結剤: ETHANE / チャンバー内温度: 93 K / 装置: HOMEMADE PLUNGER 詳細: Vitrification instrument: standard guillotine. vitrification carried out at room temperature |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI/PHILIPS CM200FEG/ST |
|---|---|
| 温度 | 平均: 93 K |
| アライメント法 | Legacy - 非点収差: objective lens astigmatism was corrected at 150K mag |
| 詳細 | low dose imaging |
| 撮影 | カテゴリ: FILM / フィルム・検出器のモデル: KODAK SO-163 FILM / デジタル化 - スキャナー: ZEISS SCAI / デジタル化 - サンプリング間隔: 21 µm / 実像数: 14 / Od range: 0.9 / ビット/ピクセル: 8 |
| Tilt angle min | 0 |
| Tilt angle max | 0 |
| 電子線 | 加速電圧: 160 kV / 電子線源: TUNGSTEN HAIRPIN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 1.26 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 38000 |
| 試料ステージ | 試料ホルダー: side entry / 試料ホルダーモデル: GATAN LIQUID NITROGEN |
- 画像解析
画像解析
| 詳細 | 257 subunits per 137 helical turns |
|---|---|
| 最終 再構成 | 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) アルゴリズム: OTHER / ソフトウェア - 名称: PHOELIX 詳細: final map was calculated from 27 datasets of near and far sides |
 ムービー
ムービー コントローラー
コントローラー



 UCSF Chimera
UCSF Chimera







 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















