+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10200 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of a marine algae virus of the order Picornavirales | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Picornavirales / Marnaviridae / icosahedral virus / algae virus / jelly roll / VIRUS | |||||||||
| 機能・相同性 | Capsid protein VP4, dicistrovirus / Cricket paralysis virus, VP4 / Dicistrovirus, capsid-polyprotein, C-terminal / CRPV capsid protein like / virion component / Picornavirus/Calicivirus coat protein / Viral coat protein subunit / Predicted structural protein / Predicted structural protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Chaetoceros tenuissimus RNA virus type-II (ウイルス) Chaetoceros tenuissimus RNA virus type-II (ウイルス) | |||||||||
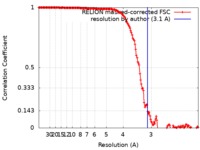
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | |||||||||
 データ登録者 データ登録者 | Munke A / Tomaru Y | |||||||||
| 資金援助 |  スウェーデン, 2件 スウェーデン, 2件
| |||||||||
 引用 引用 |  ジャーナル: J Virol / 年: 2020 ジャーナル: J Virol / 年: 2020タイトル: Capsid Structure of a Marine Algal Virus of the Order . 著者: Anna Munke / Kei Kimura / Yuji Tomaru / Kenta Okamoto /   要旨: The order includes viruses that infect different kinds of eukaryotes and that share similar properties. The capsid proteins (CPs) of viruses in the order that infect unicellular organisms, such as ...The order includes viruses that infect different kinds of eukaryotes and that share similar properties. The capsid proteins (CPs) of viruses in the order that infect unicellular organisms, such as algae, presumably possess certain characteristics that have changed little over the course of evolution, and thus these viruses may resemble the ancestor in some respects. Herein, we present the capsid structure of RNA virus type II (CtenRNAV-II) determined using cryo-electron microscopy at a resolution of 3.1 Å, the first alga virus belonging to the family of the order A structural comparison to related invertebrate and vertebrate viruses revealed a unique surface loop of the major CP VP1 that had not been observed previously, and further, revealed that another VP1 loop obscures the so-called canyon, which is a host-receptor binding site for many of the mammalian viruses. VP2 has an N-terminal tail, which has previously been reported as a primordial feature of viruses. The above-mentioned and other critical structural features provide new insights on three long-standing theories about : (i) the canyon hypothesis, (ii) the primordial VP2 domain swap, and (iii) the hypothesis that alga viruses could share characteristics with the ancestor. Identifying the acquired structural traits in virus capsids is important for elucidating what functions are essential among viruses that infect different hosts. The viruses infect a broad spectrum of hosts, ranging from unicellular algae to insects and mammals and include many human pathogens. Those viruses that infect unicellular protists, such as algae, are likely to have undergone fewer structural changes during the course of evolution compared to those viruses that infect multicellular eukaryotes and thus still share some characteristics with the ancestor. This article describes the first atomic capsid structure of an alga , CtenRNAV-II. A comparison to capsid structures of the related invertebrate and vertebrate viruses identified a number of structural traits that have been functionally acquired or lost during the course of evolution. These observations provide new insights on past theories on the viability and evolution of viruses. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10200.map.gz emd_10200.map.gz | 63.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10200-v30.xml emd-10200-v30.xml emd-10200.xml emd-10200.xml | 15.1 KB 15.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_10200_fsc.xml emd_10200_fsc.xml | 15.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_10200.png emd_10200.png | 234.2 KB | ||
| Filedesc metadata |  emd-10200.cif.gz emd-10200.cif.gz | 5.8 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10200 http://ftp.pdbj.org/pub/emdb/structures/EMD-10200 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10200 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10200 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10200_validation.pdf.gz emd_10200_validation.pdf.gz | 594.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10200_full_validation.pdf.gz emd_10200_full_validation.pdf.gz | 594.2 KB | 表示 | |
| XML形式データ |  emd_10200_validation.xml.gz emd_10200_validation.xml.gz | 15.1 KB | 表示 | |
| CIF形式データ |  emd_10200_validation.cif.gz emd_10200_validation.cif.gz | 20.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10200 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10200 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10200 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10200 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10200.map.gz / 形式: CCP4 / 大きさ: 347.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10200.map.gz / 形式: CCP4 / 大きさ: 347.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Chaetoceros tenuissimus RNA virus type-II
| 全体 | 名称:  Chaetoceros tenuissimus RNA virus type-II (ウイルス) Chaetoceros tenuissimus RNA virus type-II (ウイルス) |
|---|---|
| 要素 |
|
-超分子 #1: Chaetoceros tenuissimus RNA virus type-II
| 超分子 | 名称: Chaetoceros tenuissimus RNA virus type-II / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: all / NCBI-ID: 1516128 / 生物種: Chaetoceros tenuissimus RNA virus type-II / ウイルスタイプ: VIRION / ウイルス・単離状態: STRAIN / ウイルス・エンベロープ: No / ウイルス・中空状態: No |
|---|---|
| 宿主 | 生物種:  Chaetoceros tenuissimus (珪藻) Chaetoceros tenuissimus (珪藻) |
| ウイルス殻 | Shell ID: 1 / 名称: Capsid / T番号(三角分割数): 3 |
-分子 #1: VP1
| 分子 | 名称: VP1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Chaetoceros tenuissimus RNA virus type-II (ウイルス) Chaetoceros tenuissimus RNA virus type-II (ウイルス) |
| 分子量 | 理論値: 29.740906 KDa |
| 配列 | 文字列: DNSNNPVGGN PIDNYGTEHA PLLKEDNQYL VYQGERIVSF KDLLRRYQYL NSYWPQETGS GFRYYTLDSP GMPIYRGWDP NGIDQGQDS TAGNSPYNFC SMTLLNYLAP AFVCQRGSLR HKWVTAGARV NSTASVLSAT RHGVLFPLPL AETAHPLDNA L VGDRRSEL ...文字列: DNSNNPVGGN PIDNYGTEHA PLLKEDNQYL VYQGERIVSF KDLLRRYQYL NSYWPQETGS GFRYYTLDSP GMPIYRGWDP NGIDQGQDS TAGNSPYNFC SMTLLNYLAP AFVCQRGSLR HKWVTAGARV NSTASVLSAT RHGVLFPLPL AETAHPLDNA L VGDRRSEL QEMQRSRLNG TAITPVRLNN TLEIELPYYS IGQRFHASRF LDLAGTGDTQ GVEIACEISD GGNDANYRLD QF VSVGEDF TLGMFVGAPI MYFYNDPTAT UniProtKB: Predicted structural protein |
-分子 #2: VP2
| 分子 | 名称: VP2 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Chaetoceros tenuissimus RNA virus type-II (ウイルス) Chaetoceros tenuissimus RNA virus type-II (ウイルス) |
| 分子量 | 理論値: 25.911801 KDa |
| 配列 | 文字列: PSANDGPSFT TSKTSQNTTS ENVHFVDGDT PWTYDVAATP DETSKLSGFD DAGLGEFLSR PIKIQQYQWT PGVQLFQTFN PWSDYFGNA DVLEKINRFR NLRCKLCLKV LINGNSFYYG RALLSYNPYL RNDQVTVNRS FFIQDLIAAS NKPHILLDPC S SEGGQMCL ...文字列: PSANDGPSFT TSKTSQNTTS ENVHFVDGDT PWTYDVAATP DETSKLSGFD DAGLGEFLSR PIKIQQYQWT PGVQLFQTFN PWSDYFGNA DVLEKINRFR NLRCKLCLKV LINGNSFYYG RALLSYNPYL RNDQVTVNRS FFIQDLIAAS NKPHILLDPC S SEGGQMCL PFIWPENYLD ITSTGWEDQM GECIIHDFDV LRHANGGTDP ITVSIFAWAE DVSLLIPTTV AAQ UniProtKB: Predicted structural protein |
-分子 #3: VP3
| 分子 | 名称: VP3 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Chaetoceros tenuissimus RNA virus type-II (ウイルス) Chaetoceros tenuissimus RNA virus type-II (ウイルス) |
| 分子量 | 理論値: 28.508686 KDa |
| 配列 | 文字列: SRPAVLSDIQ PYVPRYCGNL ANSDAPETVN KLSVDSKNEL TIDTRTMGLG GADELTIHSI ASRMTFWRQF DWPESAVTDT LLASMSVQP FCIDTVTASP VTEIHSTALA FASAPFETWQ GSIKFHFKVV CSEYHRGRLR LVYNPLTNNA GPVAFNQVYS T TIDISNDR ...文字列: SRPAVLSDIQ PYVPRYCGNL ANSDAPETVN KLSVDSKNEL TIDTRTMGLG GADELTIHSI ASRMTFWRQF DWPESAVTDT LLASMSVQP FCIDTVTASP VTEIHSTALA FASAPFETWQ GSIKFHFKVV CSEYHRGRLR LVYNPLTNNA GPVAFNQVYS T TIDISNDR EFDYECKWTD IRAWNACIGI DGATSATFFN TAAAVTGGTP FDNGTLSVYV VNELATPSTA AADVKVQVWV SA GDDFAVA VPGVGLSQLS YFQQQ UniProtKB: Predicted structural protein |
-分子 #4: VP4
| 分子 | 名称: VP4 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Chaetoceros tenuissimus RNA virus type-II (ウイルス) Chaetoceros tenuissimus RNA virus type-II (ウイルス) |
| 分子量 | 理論値: 5.406366 KDa |
| 配列 | 文字列: EFKHDGLISK PASAVAKAAD ALSMIPYIAP YAKATSMVAD KIGKIARIFG Y UniProtKB: Predicted structural protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 2592 / 平均露光時間: 8.0 sec. / 平均電子線量: 29.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 140000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: BACKBONE TRACE |
|---|---|
| 得られたモデル |  PDB-6shl: |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)