+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10150 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | transthyritin derived amyloid fibril from patient with hereditary V30M ATTR amyloidosis | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | amyloid fibril / systemic ATTR amyloidosis / ex vivo / misfolding / patient tissue / transthyritin / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Defective visual phototransduction due to STRA6 loss of function / negative regulation of glomerular filtration / The canonical retinoid cycle in rods (twilight vision) / hormone binding / purine nucleobase metabolic process / molecular sequestering activity / Non-integrin membrane-ECM interactions / phototransduction, visible light / retinoid metabolic process / Retinoid metabolism and transport ...Defective visual phototransduction due to STRA6 loss of function / negative regulation of glomerular filtration / The canonical retinoid cycle in rods (twilight vision) / hormone binding / purine nucleobase metabolic process / molecular sequestering activity / Non-integrin membrane-ECM interactions / phototransduction, visible light / retinoid metabolic process / Retinoid metabolism and transport / hormone activity / azurophil granule lumen / Amyloid fiber formation / Neutrophil degranulation / protein-containing complex binding / protein-containing complex / extracellular space / extracellular exosome / extracellular region / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
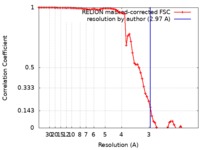
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 2.97 Å | |||||||||
 データ登録者 データ登録者 | Schmidt M / Faendrich M | |||||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2019 ジャーナル: Nat Commun / 年: 2019タイトル: Cryo-EM structure of a transthyretin-derived amyloid fibril from a patient with hereditary ATTR amyloidosis. 著者: Matthias Schmidt / Sebastian Wiese / Volkan Adak / Jonas Engler / Shubhangi Agarwal / Günter Fritz / Per Westermark / Martin Zacharias / Marcus Fändrich /   要旨: ATTR amyloidosis is one of the worldwide most abundant forms of systemic amyloidosis. The disease is caused by the misfolding of transthyretin protein and the formation of amyloid deposits at ...ATTR amyloidosis is one of the worldwide most abundant forms of systemic amyloidosis. The disease is caused by the misfolding of transthyretin protein and the formation of amyloid deposits at different sites within the body. Here, we present a 2.97 Å cryo electron microscopy structure of a fibril purified from the tissue of a patient with hereditary Val30Met ATTR amyloidosis. The fibril consists of a single protofilament that is formed from an N-terminal and a C-terminal fragment of transthyretin. Our structure provides insights into the mechanism of misfolding and implies the formation of an early fibril state from unfolded transthyretin molecules, which upon proteolysis converts into mature ATTR amyloid fibrils. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10150.map.gz emd_10150.map.gz | 952.2 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10150-v30.xml emd-10150-v30.xml emd-10150.xml emd-10150.xml | 14.8 KB 14.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_10150_fsc.xml emd_10150_fsc.xml | 7.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_10150.png emd_10150.png | 59 KB | ||
| Filedesc metadata |  emd-10150.cif.gz emd-10150.cif.gz | 5.3 KB | ||
| その他 |  emd_10150_half_map_1.map.gz emd_10150_half_map_1.map.gz emd_10150_half_map_2.map.gz emd_10150_half_map_2.map.gz | 23.3 MB 23.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10150 http://ftp.pdbj.org/pub/emdb/structures/EMD-10150 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10150 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10150 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10150_validation.pdf.gz emd_10150_validation.pdf.gz | 647 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10150_full_validation.pdf.gz emd_10150_full_validation.pdf.gz | 646.6 KB | 表示 | |
| XML形式データ |  emd_10150_validation.xml.gz emd_10150_validation.xml.gz | 12.6 KB | 表示 | |
| CIF形式データ |  emd_10150_validation.cif.gz emd_10150_validation.cif.gz | 17.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10150 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10150 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10150 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10150 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10150.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10150.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.04 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
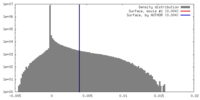
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-ハーフマップ: #2
| ファイル | emd_10150_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
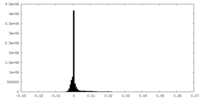
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_10150_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
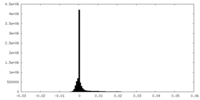
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Transthyretin derived amyloid fibril (V30M)
| 全体 | 名称: Transthyretin derived amyloid fibril (V30M) |
|---|---|
| 要素 |
|
-超分子 #1: Transthyretin derived amyloid fibril (V30M)
| 超分子 | 名称: Transthyretin derived amyloid fibril (V30M) / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all / 詳細: ex vivo ATTR amyloid fibril from human tissue |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Transthyretin
| 分子 | 名称: Transthyretin / タイプ: protein_or_peptide / ID: 1 詳細: transthyritin V30M fragments, residues 11-35 and residues 57-123 コピー数: 11 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 13.809426 KDa |
| 配列 | 文字列: GPTGTGESKC PLMVKVLDAV RGSPAINVAM HVFRKAADDT WEPFASGKTS ESGELHGLTT EEEFVEGIYK VEIDTKSYWK ALGISPFHE HAEVVFTAND SGPRRYTIAA LLSPYSYSTT AVVTNPKE UniProtKB: Transthyretin |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 緩衝液 | pH: 7 / 詳細: Water extract |
|---|---|
| グリッド | モデル: C-flat-1.2/1.3 4C / 材質: COPPER / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 20 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 96 % / 装置: FEI VITROBOT MARK III |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: RECIPROCAL / プロトコル: AB INITIO MODEL / 温度因子: 89.59 当てはまり具合の基準: Cross-correlation coefficient |
|---|---|
| 得られたモデル |  PDB-6sdz: |
 ムービー
ムービー コントローラー
コントローラー



















 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)