+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8ve0 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
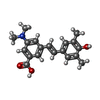
| タイトル | Human transthyretin covalently modified with A2-derived stilbene in the compressed conformation | |||||||||
 要素 要素 | Transthyretin | |||||||||
 キーワード キーワード | TRANSPORT PROTEIN / Amyloidosis | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Retinoid cycle disease events / thyroid hormone binding / The canonical retinoid cycle in rods (twilight vision) / purine nucleobase metabolic process / Non-integrin membrane-ECM interactions / Retinoid metabolism and transport / hormone activity / azurophil granule lumen / Amyloid fiber formation / Neutrophil degranulation ...Retinoid cycle disease events / thyroid hormone binding / The canonical retinoid cycle in rods (twilight vision) / purine nucleobase metabolic process / Non-integrin membrane-ECM interactions / Retinoid metabolism and transport / hormone activity / azurophil granule lumen / Amyloid fiber formation / Neutrophil degranulation / extracellular space / extracellular exosome / extracellular region / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | |||||||||
 データ登録者 データ登録者 | Basanta, B. / Nugroho, K. / Yan, N. / Kline, G.M. / Tsai, F.J. / Wu, M. / Kelly, J.W. / Lander, G.C. | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: The conformational landscape of human transthyretin revealed by cryo-EM 著者: Basanta, B. / Nugroho, K. / Yan, N. / Kline, G.M. / Powers, E.T. / Tsai, F.J. / Wu, M. / Hansel-Harris, A. / Chen, J. / Forli, S. / Kelly, J.W. / Lander, G.C. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8ve0.cif.gz 8ve0.cif.gz | 89.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8ve0.ent.gz pdb8ve0.ent.gz | 66.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8ve0.json.gz 8ve0.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8ve0_validation.pdf.gz 8ve0_validation.pdf.gz | 1.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8ve0_full_validation.pdf.gz 8ve0_full_validation.pdf.gz | 1.3 MB | 表示 | |
| XML形式データ |  8ve0_validation.xml.gz 8ve0_validation.xml.gz | 25.9 KB | 表示 | |
| CIF形式データ |  8ve0_validation.cif.gz 8ve0_validation.cif.gz | 35.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ve/8ve0 https://data.pdbj.org/pub/pdb/validation_reports/ve/8ve0 ftp://data.pdbj.org/pub/pdb/validation_reports/ve/8ve0 ftp://data.pdbj.org/pub/pdb/validation_reports/ve/8ve0 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  43160MC  8ve1C  8ve2C  8ve3C  8ve4C  8ve5C  8ve6C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 13908.557 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: TTR, PALB / 発現宿主: Homo sapiens (ヒト) / 遺伝子: TTR, PALB / 発現宿主:  #2: 化合物 | 研究の焦点であるリガンドがあるか | Y | Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Transthyretin / タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.056136 MDa / 実験値: YES | |||||||||||||||||||||||||||||||||||
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||||||||||||||||
| 由来(組換発現) | 生物種:  | |||||||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.6 | |||||||||||||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||||||||||||
| 試料 | 濃度: 0.41 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | |||||||||||||||||||||||||||||||||||
| 試料支持 | 詳細: Graphene grids were treated with UV/ozone using the UVOCS T10xT10 system. A 10-minute warmup run was performed immediately prior to inserting and treating the grids for 4 minutes. グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | |||||||||||||||||||||||||||||||||||
| 急速凍結 | 装置: HOMEMADE PLUNGER / 凍結剤: ETHANE / 湿度: 90 % / 凍結前の試料温度: 279 K 詳細: 3 uL of sample were applied onto the graphene side of the grid after it was mounted on the plunger (always at the same height), and immediately blotted for 6 seconds by holding a 1 x 6 cm ...詳細: 3 uL of sample were applied onto the graphene side of the grid after it was mounted on the plunger (always at the same height), and immediately blotted for 6 seconds by holding a 1 x 6 cm piece of Whatman 1 filter paper parallel to the grid, in full contact. Timing was kept with the help of a metronome. The blotting countdown was started after the blotted liquid spot on the filter paper stopped spreading and the grid was plunged in liquid ethane at the same time the blotting paper was pulled back, in a single motion. |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TALOS ARCTICA |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 73000 X / 倍率(補正後): 88968 X / 最大 デフォーカス(公称値): 1500 nm / 最小 デフォーカス(公称値): 500 nm / Calibrated defocus min: 500 nm / 最大 デフォーカス(補正後): 1500 nm / Cs: 2.7 mm / C2レンズ絞り径: 50 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER 最高温度: 85 K / 最低温度: 78 K |
| 撮影 | 平均露光時間: 6.8 sec. / 電子線照射量: 50 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 撮影したグリッド数: 1 / 実像数: 4536 |
| 画像スキャン | サンプリングサイズ: 5 µm / 横: 3838 / 縦: 3710 / 動画フレーム数/画像: 50 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 105961 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー









 PDBj
PDBj