[English] 日本語
 Yorodumi
Yorodumi- EMDB-43166: (Biarylamine-FT2-WT)1(C10A)3-human transthyretin in the frayed co... -
+ Open data
Open data
- Basic information
Basic information
| Entry |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | (Biarylamine-FT2-WT)1(C10A)3-human transthyretin in the frayed conformation | |||||||||
 Map data Map data | Single-bound TTR frayed map | |||||||||
 Sample Sample |
| |||||||||
 Keywords Keywords | Amyloidosis / TRANSPORT PROTEIN | |||||||||
| Function / homology |  Function and homology information Function and homology informationDefective visual phototransduction due to STRA6 loss of function / negative regulation of glomerular filtration / The canonical retinoid cycle in rods (twilight vision) / purine nucleobase metabolic process / hormone binding / Non-integrin membrane-ECM interactions / molecular sequestering activity / phototransduction, visible light / retinoid metabolic process / Retinoid metabolism and transport ...Defective visual phototransduction due to STRA6 loss of function / negative regulation of glomerular filtration / The canonical retinoid cycle in rods (twilight vision) / purine nucleobase metabolic process / hormone binding / Non-integrin membrane-ECM interactions / molecular sequestering activity / phototransduction, visible light / retinoid metabolic process / Retinoid metabolism and transport / hormone activity / azurophil granule lumen / Amyloid fiber formation / Neutrophil degranulation / protein-containing complex binding / protein-containing complex / extracellular space / extracellular exosome / extracellular region / identical protein binding Similarity search - Function | |||||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | |||||||||
| Method | single particle reconstruction / cryo EM / Resolution: 4.1 Å | |||||||||
 Authors Authors | Basanta B / Nugroho K / Yan N / Kline GM / Tsai FJ / Wu M / Kelly JW / Lander GC | |||||||||
| Funding support |  United States, 2 items United States, 2 items
| |||||||||
 Citation Citation |  Journal: Nat Struct Mol Biol / Year: 2025 Journal: Nat Struct Mol Biol / Year: 2025Title: The conformational landscape of human transthyretin revealed by cryo-EM. Authors: Benjamin Basanta / Karina Nugroho / Nicholas L Yan / Gabriel M Kline / Evan T Powers / Felix J Tsai / Mengyu Wu / Althea Hansel-Harris / Jason S Chen / Stefano Forli / Jeffrey W Kelly / Gabriel C Lander /  Abstract: Transthyretin (TTR) is a natively tetrameric thyroxine transporter in blood and cerebrospinal fluid whose misfolding and aggregation causes TTR amyloidosis. A rational drug design campaign identified ...Transthyretin (TTR) is a natively tetrameric thyroxine transporter in blood and cerebrospinal fluid whose misfolding and aggregation causes TTR amyloidosis. A rational drug design campaign identified the small molecule tafamidis (Vyndamax) as a stabilizer of the native TTR fold, and this aggregation inhibitor is regulatory agency approved for the treatment of TTR amyloidosis. Here we used cryo-EM to investigate the conformational landscape of this 55 kDa tetramer in the absence and presence of one or two ligands, revealing inherent asymmetries in the tetrameric architecture and previously unobserved conformational states. These findings provide critical mechanistic insights into negatively cooperative ligand binding and the structural pathways responsible for TTR amyloidogenesis, underscoring the capacity of cryo-EM to identify pharmacological targets suppressed by the confines of the crystal lattice, opening uncharted territory in structure-based drug design. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Supplemental images |
|---|
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_43166.map.gz emd_43166.map.gz | 8 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-43166-v30.xml emd-43166-v30.xml emd-43166.xml emd-43166.xml | 22.7 KB 22.7 KB | Display Display |  EMDB header EMDB header |
| Images |  emd_43166.png emd_43166.png | 59.7 KB | ||
| Masks |  emd_43166_msk_1.map emd_43166_msk_1.map | 64 MB |  Mask map Mask map | |
| Filedesc metadata |  emd-43166.cif.gz emd-43166.cif.gz | 7 KB | ||
| Others |  emd_43166_half_map_1.map.gz emd_43166_half_map_1.map.gz emd_43166_half_map_2.map.gz emd_43166_half_map_2.map.gz | 49.6 MB 49.7 MB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-43166 http://ftp.pdbj.org/pub/emdb/structures/EMD-43166 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43166 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43166 | HTTPS FTP |
-Related structure data
| Related structure data |  8ve6MC  8u52C  8ve0C  8ve1C  8ve2C  8ve3C  8ve4C  8ve5C M: atomic model generated by this map C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| Related items in Molecule of the Month |
- Map
Map
| File |  Download / File: emd_43166.map.gz / Format: CCP4 / Size: 64 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_43166.map.gz / Format: CCP4 / Size: 64 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | Single-bound TTR frayed map | ||||||||||||||||||||||||||||||||||||
| Projections & slices | Image control
Images are generated by Spider. | ||||||||||||||||||||||||||||||||||||
| Voxel size | X=Y=Z: 0.562 Å | ||||||||||||||||||||||||||||||||||||
| Density |
| ||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
|
-Supplemental data
-Mask #1
| File |  emd_43166_msk_1.map emd_43166_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & Slices |
| ||||||||||||
| Density Histograms |
-Half map: Single-bound TTR frayed half map 2
| File | emd_43166_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | Single-bound TTR frayed half map 2 | ||||||||||||
| Projections & Slices |
| ||||||||||||
| Density Histograms |
-Half map: Single-bound TTR frayed half map 1
| File | emd_43166_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | Single-bound TTR frayed half map 1 | ||||||||||||
| Projections & Slices |
| ||||||||||||
| Density Histograms |
- Sample components
Sample components
-Entire : Transthyretin
| Entire | Name: Transthyretin |
|---|---|
| Components |
|
-Supramolecule #1: Transthyretin
| Supramolecule | Name: Transthyretin / type: complex / ID: 1 / Parent: 0 / Macromolecule list: #1 |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Molecular weight | Theoretical: 57.82 KDa |
-Macromolecule #1: Transthyretin
| Macromolecule | Name: Transthyretin / type: protein_or_peptide / ID: 1 / Number of copies: 4 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Molecular weight | Theoretical: 15.902508 KDa |
| Recombinant expression | Organism:  |
| Sequence | String: MDYKDDDDKD YKDDDDKGPT GTGESKCPLM VKVLDAVRGS PAINVAVHVF RKAADDTWEP FASGKTSESG ELHGLTTEEE FVEGIYKVE IDTKSYWKAL GISPFHEHAE VVFTANDSGP RRYTIAALLS PYSYSTTAVV TNPKE UniProtKB: Transthyretin |
-Macromolecule #2: 2-[(3,5-DICHLORO-4-TRIOXIDANYLPHENYL)AMINO]BENZOIC ACID
| Macromolecule | Name: 2-[(3,5-DICHLORO-4-TRIOXIDANYLPHENYL)AMINO]BENZOIC ACID type: ligand / ID: 2 / Number of copies: 1 / Formula: P2C |
|---|---|
| Molecular weight | Theoretical: 330.12 Da |
| Chemical component information | 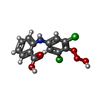 ChemComp-P2C: |
-Experimental details
-Structure determination
| Method | cryo EM |
|---|---|
 Processing Processing | single particle reconstruction |
| Aggregation state | particle |
- Sample preparation
Sample preparation
| Concentration | 0.9 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Buffer | pH: 7.6 Component:
| |||||||||||||||
| Grid | Model: Quantifoil R1.2/1.3 / Material: GOLD / Mesh: 300 / Support film - Material: GRAPHENE / Support film - topology: CONTINUOUS / Pretreatment - Time: 240 sec. / Pretreatment - Atmosphere: OTHER Details: The graphene grids were treated with UV/ozone using the UVOCS T10xT10 system. A 10-minute warmup run was performed immediately prior to inserting and treating grids for 4 minutes. | |||||||||||||||
| Vitrification | Cryogen name: ETHANE / Chamber humidity: 90 % / Chamber temperature: 279 K / Instrument: HOMEMADE PLUNGER Details: 3 uL of sample were applied onto the graphene side of the grid after it was mounted on the plunger (always at the same height), and immediately blotted for 3 seconds by holding a 1 x 6 cm ...Details: 3 uL of sample were applied onto the graphene side of the grid after it was mounted on the plunger (always at the same height), and immediately blotted for 3 seconds by holding a 1 x 6 cm piece of Whatman 1 filter paper parallel to the grid, in full contact. Timing was kept with the help of a metronome. The blotting countdown was started after the blotted liquid spot on the filter paper stopped spreading and the grid was plunged in liquid ethane at the same time the blotting paper was pulled back, in a single motion.. |
- Electron microscopy
Electron microscopy
| Microscope | FEI TALOS ARCTICA |
|---|---|
| Temperature | Min: 78.0 K / Max: 85.0 K |
| Image recording | Film or detector model: GATAN K2 SUMMIT (4k x 4k) / Detector mode: COUNTING / Digitization - Dimensions - Width: 3838 pixel / Digitization - Dimensions - Height: 3710 pixel / Digitization - Frames/image: 1-50 / Number grids imaged: 1 / Number real images: 7939 / Average exposure time: 6.8 sec. / Average electron dose: 50.0 e/Å2 |
| Electron beam | Acceleration voltage: 200 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | C2 aperture diameter: 50.0 µm / Calibrated defocus max: 1.5 µm / Calibrated defocus min: 0.5 µm / Calibrated magnification: 88968 / Illumination mode: FLOOD BEAM / Imaging mode: BRIGHT FIELD / Cs: 2.7 mm / Nominal defocus max: 1.5 µm / Nominal defocus min: 0.5 µm / Nominal magnification: 73000 |
| Sample stage | Specimen holder model: FEI TITAN KRIOS AUTOGRID HOLDER / Cooling holder cryogen: NITROGEN |
| Experimental equipment |  Model: Talos Arctica / Image courtesy: FEI Company |
+ Image processing
Image processing
-Atomic model buiding 1
| Refinement | Space: REAL |
|---|---|
| Output model |  PDB-8ve6: |
 Movie
Movie Controller
Controller














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)