+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8s9s | ||||||
|---|---|---|---|---|---|---|---|
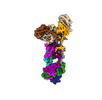
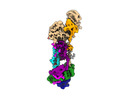
| タイトル | Structure of the human ER membrane protein complex (EMC) in GDN | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | MEMBRANE PROTEIN / Insertase / endoplasmic reticulum / transmembrane chaperone | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報extrinsic component of endoplasmic reticulum membrane / inorganic cation transmembrane transporter activity / EMC complex / omegasome membrane / protein insertion into ER membrane by stop-transfer membrane-anchor sequence / magnesium ion transport / cobalt ion transmembrane transporter activity / Miscellaneous transport and binding events / tail-anchored membrane protein insertion into ER membrane / magnesium ion transmembrane transporter activity ...extrinsic component of endoplasmic reticulum membrane / inorganic cation transmembrane transporter activity / EMC complex / omegasome membrane / protein insertion into ER membrane by stop-transfer membrane-anchor sequence / magnesium ion transport / cobalt ion transmembrane transporter activity / Miscellaneous transport and binding events / tail-anchored membrane protein insertion into ER membrane / magnesium ion transmembrane transporter activity / ferrous iron transmembrane transporter activity / protein folding in endoplasmic reticulum / copper ion transport / autophagosome assembly / RHOA GTPase cycle / positive regulation of endothelial cell proliferation / positive regulation of endothelial cell migration / positive regulation of angiogenesis / early endosome membrane / carbohydrate binding / angiogenesis / early endosome / Golgi membrane / apoptotic process / endoplasmic reticulum membrane / Golgi apparatus / endoplasmic reticulum / protein-containing complex / extracellular region / membrane / plasma membrane / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å | ||||||
 データ登録者 データ登録者 | Tomaleri, G.P. / Nguyen, V.N. / Voorhees, R.M. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: J Cell Biol / 年: 2023 ジャーナル: J Cell Biol / 年: 2023タイトル: A selectivity filter in the ER membrane protein complex limits protein misinsertion at the ER. 著者: Tino Pleiner / Masami Hazu / Giovani Pinton Tomaleri / Vy N Nguyen / Kurt Januszyk / Rebecca M Voorhees /  要旨: Tail-anchored (TA) proteins play essential roles in mammalian cells, and their accurate localization is critical for proteostasis. Biophysical similarities lead to mistargeting of mitochondrial TA ...Tail-anchored (TA) proteins play essential roles in mammalian cells, and their accurate localization is critical for proteostasis. Biophysical similarities lead to mistargeting of mitochondrial TA proteins to the ER, where they are delivered to the insertase, the ER membrane protein complex (EMC). Leveraging an improved structural model of the human EMC, we used mutagenesis and site-specific crosslinking to map the path of a TA protein from its cytosolic capture by methionine-rich loops to its membrane insertion through a hydrophilic vestibule. Positively charged residues at the entrance to the vestibule function as a selectivity filter that uses charge-repulsion to reject mitochondrial TA proteins. Similarly, this selectivity filter retains the positively charged soluble domains of multipass substrates in the cytosol, thereby ensuring they adopt the correct topology and enforcing the "positive-inside" rule. Substrate discrimination by the EMC provides a biochemical explanation for one role of charge in TA protein sorting and protects compartment integrity by limiting protein misinsertion. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8s9s.cif.gz 8s9s.cif.gz | 493.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8s9s.ent.gz pdb8s9s.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  8s9s.json.gz 8s9s.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8s9s_validation.pdf.gz 8s9s_validation.pdf.gz | 1.7 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8s9s_full_validation.pdf.gz 8s9s_full_validation.pdf.gz | 1.8 MB | 表示 | |
| XML形式データ |  8s9s_validation.xml.gz 8s9s_validation.xml.gz | 78.2 KB | 表示 | |
| CIF形式データ |  8s9s_validation.cif.gz 8s9s_validation.cif.gz | 111.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/s9/8s9s https://data.pdbj.org/pub/pdb/validation_reports/s9/8s9s ftp://data.pdbj.org/pub/pdb/validation_reports/s9/8s9s ftp://data.pdbj.org/pub/pdb/validation_reports/s9/8s9s | HTTPS FTP |
-関連構造データ
| 関連構造データ |  40245MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-ER membrane protein complex subunit ... , 8種, 8分子 123467810
| #1: タンパク質 | 分子量: 111886.141 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q8N766 Homo sapiens (ヒト) / 参照: UniProt: Q8N766 |
|---|---|
| #2: タンパク質 | 分子量: 34882.531 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q15006 Homo sapiens (ヒト) / 参照: UniProt: Q15006 |
| #3: タンパク質 | 分子量: 29981.924 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q9P0I2 Homo sapiens (ヒト) / 参照: UniProt: Q9P0I2 |
| #4: タンパク質 | 分子量: 20104.572 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q5J8M3 Homo sapiens (ヒト) / 参照: UniProt: Q5J8M3 |
| #6: タンパク質 | 分子量: 12029.248 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q9BV81 Homo sapiens (ヒト) / 参照: UniProt: Q9BV81 |
| #7: タンパク質 | 分子量: 26501.586 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q9NPA0 Homo sapiens (ヒト) / 参照: UniProt: Q9NPA0 |
| #8: タンパク質 | 分子量: 23807.076 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: O43402 Homo sapiens (ヒト) / 参照: UniProt: O43402 |
| #9: タンパク質 | 分子量: 27375.797 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q5UCC4 Homo sapiens (ヒト) / 参照: UniProt: Q5UCC4 |
-タンパク質 / 非ポリマー , 2種, 7分子 5

| #12: 化合物 | ChemComp-PCW / #5: タンパク質 | | 分子量: 14706.786 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q8N4V1 Homo sapiens (ヒト) / 参照: UniProt: Q8N4V1 |
|---|
-糖 , 2種, 4分子 
| #10: 多糖 | | #11: 糖 | ChemComp-NAG / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Human ER Membrane Protein Complex / タイプ: COMPLEX / Entity ID: #1-#9 / 由来: NATURAL | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 実験値: NO | ||||||||||||||||||||||||||||||
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / Cell: HEK293 Homo sapiens (ヒト) / Cell: HEK293 | ||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 | ||||||||||||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||||||||||||
| 試料 | 濃度: 0.5 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES / 詳細: Sample solubilized and purified in GDN | ||||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | ||||||||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 95 % / 凍結前の試料温度: 279 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: SPOT SCAN FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: SPOT SCAN |
| 電子レンズ | モード: DARK FIELD / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 3000 nm / 最小 デフォーカス(公称値): 1000 nm / Cs: 2.7 mm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 2.66 sec. / 電子線照射量: 60 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 2 / 実像数: 11822 |
| 電子光学装置 | エネルギーフィルター名称: GIF Quantum LS / エネルギーフィルタースリット幅: 20 eV |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | |||||||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 1034250 | |||||||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 156706 / 対称性のタイプ: POINT | |||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL | |||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | 交差検証法: NONE 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2 | |||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 115.7 Å2 | |||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj








