+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8qa0 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
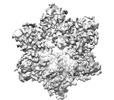
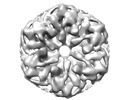
| タイトル | Cryo-EM structure of Cx26 solubilised in LMNG - hemichannel classification - NConst conformation | |||||||||
 要素 要素 | Gap junction beta-2 protein | |||||||||
 キーワード キーワード | MEMBRANE PROTEIN / Gap junction Large Pore Channel Carbon dioxide sensitive | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Transport of connexons to the plasma membrane / response to human chorionic gonadotropin / gap junction-mediated intercellular transport / epididymis development / gap junction channel activity involved in cell communication by electrical coupling / Oligomerization of connexins into connexons / Transport of connexins along the secretory pathway / gap junction assembly / connexin complex / gap junction ...Transport of connexons to the plasma membrane / response to human chorionic gonadotropin / gap junction-mediated intercellular transport / epididymis development / gap junction channel activity involved in cell communication by electrical coupling / Oligomerization of connexins into connexons / Transport of connexins along the secretory pathway / gap junction assembly / connexin complex / gap junction / Gap junction assembly / gap junction channel activity / astrocyte projection / cellular response to glucagon stimulus / inner ear development / endoplasmic reticulum-Golgi intermediate compartment / decidualization / lateral plasma membrane / cellular response to dexamethasone stimulus / response to retinoic acid / response to ischemia / response to progesterone / sensory perception of sound / transmembrane transport / response to estradiol / cell-cell signaling / cellular response to oxidative stress / cell body / response to lipopolysaccharide / calcium ion binding / perinuclear region of cytoplasm / identical protein binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.3 Å | |||||||||
 データ登録者 データ登録者 | Brotherton, D.H. / Cameron, A.D. | |||||||||
| 資金援助 |  英国, 2件 英国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2024 ジャーナル: Elife / 年: 2024タイトル: Structures of wild-type and a constitutively closed mutant of connexin26 shed light on channel regulation by CO. 著者: Deborah H Brotherton / Sarbjit Nijjar / Christos G Savva / Nicholas Dale / Alexander David Cameron /  要旨: Connexins allow intercellular communication by forming gap junction channels (GJCs) between juxtaposed cells. Connexin26 (Cx26) can be regulated directly by CO. This is proposed to be mediated ...Connexins allow intercellular communication by forming gap junction channels (GJCs) between juxtaposed cells. Connexin26 (Cx26) can be regulated directly by CO. This is proposed to be mediated through carbamylation of K125. We show that mutating K125 to glutamate, mimicking the negative charge of carbamylation, causes Cx26 GJCs to be constitutively closed. Through cryo-EM we observe that the K125E mutation pushes a conformational equilibrium towards the channel having a constricted pore entrance, similar to effects seen on raising the partial pressure of CO. In previous structures of connexins, the cytoplasmic loop, important in regulation and where K125 is located, is disordered. Through further cryo-EM studies we trap distinct states of Cx26 and observe density for the cytoplasmic loop. The interplay between the position of this loop, the conformations of the transmembrane helices and the position of the N-terminal helix, which controls the aperture to the pore, provides a mechanism for regulation. #1:  ジャーナル: Elife / 年: 2024 ジャーナル: Elife / 年: 2024タイトル: Structures of wild-type and a constitutively closed mutant of connexin26 shed light on channel regulation by CO2 著者: Brotherton, D.H. / Nijjar, S. / Savva, C.G. / Dale, N. / Cameron, A.D. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8qa0.cif.gz 8qa0.cif.gz | 606.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8qa0.ent.gz pdb8qa0.ent.gz | 406.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8qa0.json.gz 8qa0.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8qa0_validation.pdf.gz 8qa0_validation.pdf.gz | 1.6 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8qa0_full_validation.pdf.gz 8qa0_full_validation.pdf.gz | 1.6 MB | 表示 | |
| XML形式データ |  8qa0_validation.xml.gz 8qa0_validation.xml.gz | 82.2 KB | 表示 | |
| CIF形式データ |  8qa0_validation.cif.gz 8qa0_validation.cif.gz | 116.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qa/8qa0 https://data.pdbj.org/pub/pdb/validation_reports/qa/8qa0 ftp://data.pdbj.org/pub/pdb/validation_reports/qa/8qa0 ftp://data.pdbj.org/pub/pdb/validation_reports/qa/8qa0 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  18291MC  8q9zC  8qa1C  8qa2C  8qa3C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 26713.674 Da / 分子数: 12 / 由来タイプ: 組換発現 / 詳細: Connexin 26 subunit / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GJB2 Homo sapiens (ヒト) / 遺伝子: GJB2発現宿主:  参照: UniProt: P29033 #2: 化合物 | ChemComp-PTY / #3: 水 | ChemComp-HOH / | 研究の焦点であるリガンドがあるか | N | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Connexin 26, 90mmHg PCO2, pH7.4, solubilised in LMNG. タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT | |||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 実験値: NO | |||||||||||||||||||||||||||||||||||||||||||||
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||||||||||||||||||||||||||
| 由来(組換発現) | 生物種:  | |||||||||||||||||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.4 詳細: The buffer, except LMNG and DTT, was prepared fresh from 10x stock on day of used. The basal buffer was filtered and degassed and DDM and DTT added. The buffer was pH corrected at point of ...詳細: The buffer, except LMNG and DTT, was prepared fresh from 10x stock on day of used. The basal buffer was filtered and degassed and DDM and DTT added. The buffer was pH corrected at point of use to pH 7.4 using 15% CO2 in 85% N2. | |||||||||||||||||||||||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||||||||||||||||||||||
| 試料 | 濃度: 3.7 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | |||||||||||||||||||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのタイプ: UltrAuFoil | |||||||||||||||||||||||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK I / 凍結剤: ETHANE-PROPANE 詳細: Blot 3 seconds, force 10, 1 blot, skip transfer. 3ul sample, in 15% CO2/85%N2 atmosphere |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 2300 nm / 最小 デフォーカス(公称値): 800 nm |
| 試料ホルダ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 43 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 実像数: 11362 |
| 電子光学装置 | エネルギーフィルター名称: GIF Bioquantum |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 7652471 | ||||||||||||||||||||||||||||
| 対称性 | 点対称性: C6 (6回回転対称) | ||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 35007 / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||
| 原子モデル構築 | 空間: REAL | ||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 7QEQ Accession code: 7QEQ / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||||||
| 精密化 | 交差検証法: NONE 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2 | ||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 77.07 Å2 | ||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー








 PDBj
PDBj



