+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8ccy | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human heparan sulfate N-deacetylase-N-sulfotransferase 1 in complex with calcium and 3'-phosphoadenosine-5'-phosphosulfate | |||||||||||||||||||||
 要素 要素 | Bifunctional heparan sulfate N-deacetylase/N-sulfotransferase 1 | |||||||||||||||||||||
 キーワード キーワード | CARBOHYDRATE / Deacetylase / Sulfotransferase / Heparan Sulfate / Glycosaminoglycan | |||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報[heparan sulfate]-glucosamine N-sulfotransferase / [heparan sulfate]-glucosamine N-sulfotransferase activity / heparan sulfate N-deacetylase activity / N-acetylglucosamine deacetylase activity / heparan sulfate proteoglycan biosynthetic process, enzymatic modification / heparan sulfate proteoglycan biosynthetic process, polysaccharide chain biosynthetic process / heparin biosynthetic process / embryonic neurocranium morphogenesis / embryonic viscerocranium morphogenesis / HS-GAG biosynthesis ...[heparan sulfate]-glucosamine N-sulfotransferase / [heparan sulfate]-glucosamine N-sulfotransferase activity / heparan sulfate N-deacetylase activity / N-acetylglucosamine deacetylase activity / heparan sulfate proteoglycan biosynthetic process, enzymatic modification / heparan sulfate proteoglycan biosynthetic process, polysaccharide chain biosynthetic process / heparin biosynthetic process / embryonic neurocranium morphogenesis / embryonic viscerocranium morphogenesis / HS-GAG biosynthesis / deacetylase activity / cardiac septum development / respiratory gaseous exchange by respiratory system / coronary vasculature development / positive regulation of smoothened signaling pathway / aorta development / 加水分解酵素; ペプチド以外のCN結合加水分解酵素; 鎖状アミドに作用 / midbrain development / fibroblast growth factor receptor signaling pathway / forebrain development / trans-Golgi network membrane / cell population proliferation / positive regulation of MAPK cascade / inflammatory response / Golgi membrane / Golgi apparatus 類似検索 - 分子機能 | |||||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.7 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | Mycroft-West, C.J. / Wu, L. | |||||||||||||||||||||
| 資金援助 |  英国, 6件 英国, 6件
| |||||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Structural and mechanistic characterization of bifunctional heparan sulfate N-deacetylase-N-sulfotransferase 1. 著者: Courtney J Mycroft-West / Sahar Abdelkarim / Helen M E Duyvesteyn / Neha S Gandhi / Mark A Skidmore / Raymond J Owens / Liang Wu /    要旨: Heparan sulfate (HS) polysaccharides are major constituents of the extracellular matrix, which are involved in myriad structural and signaling processes. Mature HS polysaccharides contain complex, ...Heparan sulfate (HS) polysaccharides are major constituents of the extracellular matrix, which are involved in myriad structural and signaling processes. Mature HS polysaccharides contain complex, non-templated patterns of sulfation and epimerization, which mediate interactions with diverse protein partners. Complex HS modifications form around initial clusters of glucosamine-N-sulfate (GlcNS) on nascent polysaccharide chains, but the mechanistic basis underpinning incorporation of GlcNS itself into HS remains unclear. Here, we determine cryo-electron microscopy structures of human N-deacetylase-N-sulfotransferase (NDST)1, the bifunctional enzyme primarily responsible for initial GlcNS modification of HS. Our structures reveal the architecture of both NDST1 deacetylase and sulfotransferase catalytic domains, alongside a non-catalytic N-terminal domain. The two catalytic domains of NDST1 adopt a distinct back-to-back topology that limits direct cooperativity. Binding analyses, aided by activity-modulating nanobodies, suggest that anchoring of the substrate at the sulfotransferase domain initiates the NDST1 catalytic cycle, providing a plausible mechanism for cooperativity despite spatial domain separation. Our data shed light on key determinants of NDST1 activity, and describe tools to probe NDST1 function in vitro and in vivo. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8ccy.cif.gz 8ccy.cif.gz | 206.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8ccy.ent.gz pdb8ccy.ent.gz | 128.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8ccy.json.gz 8ccy.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8ccy_validation.pdf.gz 8ccy_validation.pdf.gz | 1.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8ccy_full_validation.pdf.gz 8ccy_full_validation.pdf.gz | 1.3 MB | 表示 | |
| XML形式データ |  8ccy_validation.xml.gz 8ccy_validation.xml.gz | 42.5 KB | 表示 | |
| CIF形式データ |  8ccy_validation.cif.gz 8ccy_validation.cif.gz | 62 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/cc/8ccy https://data.pdbj.org/pub/pdb/validation_reports/cc/8ccy ftp://data.pdbj.org/pub/pdb/validation_reports/cc/8ccy ftp://data.pdbj.org/pub/pdb/validation_reports/cc/8ccy | HTTPS FTP |
-関連構造データ
| 関連構造データ |  16564MC  8cd0C  8chsC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 92407.461 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: NDST1, HSST, HSST1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: NDST1, HSST, HSST1 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ)参照: UniProt: P52848, 加水分解酵素; ペプチド以外のCN結合加水分解酵素; 鎖状アミドに作用, [heparan sulfate]-glucosamine N-sulfotransferase | ||||
|---|---|---|---|---|---|
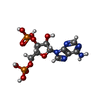
| #2: 化合物 | ChemComp-A3P / | ||||
| #3: 化合物 | | #4: 水 | ChemComp-HOH / | 研究の焦点であるリガンドがあるか | Y | |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Human heparan sulfate N-deacetylase-N-sulfotransferase 1 タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 緩衝液 | pH: 6.5 |
| 試料 | 濃度: 0.4 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES / 詳細: Monodisperse sample from size exclusion |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: TFS KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 165000 X / 最大 デフォーカス(公称値): 2600 nm / 最小 デフォーカス(公称値): 1200 nm |
| 撮影 | 電子線照射量: 50 e/Å2 フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) |
- 解析
解析
| EMソフトウェア | 名称: EPU / カテゴリ: 画像取得 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.7 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 371778 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 精密化 | 交差検証法: NONE 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2 | ||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 85.48 Å2 | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj