+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7yfl | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of GluN1a-GluN2D NMDA receptor in complex with agonists glycine and glutamate. | ||||||||||||||||||
 要素 要素 | (Glutamate receptor ionotropic, NMDA ...) x 2 | ||||||||||||||||||
 キーワード キーワード | ELECTRON TRANSPORT / ion channel / cryo-EM structure / glutamate receptor / synaptic protein | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of sensory perception of pain / excitatory chemical synaptic transmission / Synaptic adhesion-like molecules / cellular response to L-glutamate / propylene metabolic process / response to glycine / voltage-gated monoatomic cation channel activity / Assembly and cell surface presentation of NMDA receptors / regulation of monoatomic cation transmembrane transport / NMDA glutamate receptor activity ...regulation of sensory perception of pain / excitatory chemical synaptic transmission / Synaptic adhesion-like molecules / cellular response to L-glutamate / propylene metabolic process / response to glycine / voltage-gated monoatomic cation channel activity / Assembly and cell surface presentation of NMDA receptors / regulation of monoatomic cation transmembrane transport / NMDA glutamate receptor activity / Neurexins and neuroligins / NMDA selective glutamate receptor complex / ligand-gated sodium channel activity / calcium ion transmembrane import into cytosol / glutamate binding / protein heterotetramerization / positive regulation of reactive oxygen species biosynthetic process / glycine binding / positive regulation of calcium ion transport into cytosol / monoatomic cation transmembrane transport / Negative regulation of NMDA receptor-mediated neuronal transmission / startle response / Unblocking of NMDA receptors, glutamate binding and activation / regulation of neuronal synaptic plasticity / monoatomic cation transport / Long-term potentiation / ligand-gated monoatomic ion channel activity / positive regulation of excitatory postsynaptic potential / excitatory synapse / synaptic cleft / glutamate-gated receptor activity / calcium ion homeostasis / presynaptic active zone membrane / glutamate-gated calcium ion channel activity / ligand-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / EPHB-mediated forward signaling / sodium ion transmembrane transport / ionotropic glutamate receptor signaling pathway / Ras activation upon Ca2+ influx through NMDA receptor / positive regulation of synaptic transmission, glutamatergic / hippocampal mossy fiber to CA3 synapse / adult locomotory behavior / excitatory postsynaptic potential / synaptic transmission, glutamatergic / transmitter-gated monoatomic ion channel activity involved in regulation of postsynaptic membrane potential / regulation of membrane potential / long-term synaptic potentiation / synaptic membrane / visual learning / postsynaptic density membrane / brain development / regulation of synaptic plasticity / terminal bouton / calcium ion transmembrane transport / synaptic vesicle / signaling receptor activity / amyloid-beta binding / RAF/MAP kinase cascade / chemical synaptic transmission / response to ethanol / postsynaptic membrane / dendritic spine / calmodulin binding / postsynaptic density / neuron projection / dendrite / synapse / calcium ion binding / endoplasmic reticulum membrane / protein-containing complex binding / glutamatergic synapse / cell surface / positive regulation of transcription by RNA polymerase II / plasma membrane / cytoplasm 類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.9 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Zhang, J.L. / Zhu, S.J. / Zhang, M. | ||||||||||||||||||
| 資金援助 |  中国, 5件 中国, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2023 ジャーナル: Nat Struct Mol Biol / 年: 2023タイトル: Distinct structure and gating mechanism in diverse NMDA receptors with GluN2C and GluN2D subunits. 著者: Jilin Zhang / Ming Zhang / Qinrui Wang / Han Wen / Zheyi Liu / Fangjun Wang / Yuhang Wang / Fenyong Yao / Nan Song / Zengwei Kou / Yang Li / Fei Guo / Shujia Zhu /  要旨: N-methyl-D-aspartate (NMDA) receptors are heterotetramers comprising two GluN1 and two alternate GluN2 (N2A-N2D) subunits. Here we report full-length cryo-EM structures of the human N1-N2D di- ...N-methyl-D-aspartate (NMDA) receptors are heterotetramers comprising two GluN1 and two alternate GluN2 (N2A-N2D) subunits. Here we report full-length cryo-EM structures of the human N1-N2D di-heterotetramer (di-receptor), rat N1-N2C di-receptor and N1-N2A-N2C tri-heterotetramer (tri-receptor) at a best resolution of 3.0 Å. The bilobate N-terminal domain (NTD) in N2D intrinsically adopts a closed conformation, leading to a compact NTD tetramer in the N1-N2D receptor. Additionally, crosslinking the ligand-binding domain (LBD) of two N1 protomers significantly elevated the channel open probability (Po) in N1-N2D di-receptors. Surprisingly, the N1-N2C di-receptor adopted both symmetric (minor) and asymmetric (major) conformations, the latter further locked by an allosteric potentiator, PYD-106, binding to a pocket between the NTD and LBD in only one N2C protomer. Finally, the N2A and N2C subunits in the N1-N2A-N2C tri-receptor display a conformation close to one protomer in the N1-N2A and N1-N2C di-receptors, respectively. These findings provide a comprehensive structural understanding of diverse function in major NMDA receptor subtypes. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7yfl.cif.gz 7yfl.cif.gz | 477.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7yfl.ent.gz pdb7yfl.ent.gz | 370.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7yfl.json.gz 7yfl.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7yfl_validation.pdf.gz 7yfl_validation.pdf.gz | 1.6 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7yfl_full_validation.pdf.gz 7yfl_full_validation.pdf.gz | 1.7 MB | 表示 | |
| XML形式データ |  7yfl_validation.xml.gz 7yfl_validation.xml.gz | 83.2 KB | 表示 | |
| CIF形式データ |  7yfl_validation.cif.gz 7yfl_validation.cif.gz | 125.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/yf/7yfl https://data.pdbj.org/pub/pdb/validation_reports/yf/7yfl ftp://data.pdbj.org/pub/pdb/validation_reports/yf/7yfl ftp://data.pdbj.org/pub/pdb/validation_reports/yf/7yfl | HTTPS FTP |
-関連構造データ
| 関連構造データ |  33792MC  7yffC  7yfgC  7yfhC  7yfiC  7yfmC  7yfoC  7yfrC  8hdkC C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Glutamate receptor ionotropic, NMDA ... , 2種, 4分子 ACBD
| #1: タンパク質 | 分子量: 95236.078 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GRIN1, NMDAR1 / プラスミド: pEG-BacMam / Cell (発現宿主): Kidney embryonic cells / 細胞株 (発現宿主): HEK293S GnTI- / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GRIN1, NMDAR1 / プラスミド: pEG-BacMam / Cell (発現宿主): Kidney embryonic cells / 細胞株 (発現宿主): HEK293S GnTI- / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q05586 Homo sapiens (ヒト) / 参照: UniProt: Q05586#2: タンパク質 | 分子量: 97226.414 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GRIN2D, GluN2D, NMDAR2D / プラスミド: pEG-BacMam / Cell (発現宿主): Kidney embryonic cells / 細胞株 (発現宿主): HEK293S GnTI- / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GRIN2D, GluN2D, NMDAR2D / プラスミド: pEG-BacMam / Cell (発現宿主): Kidney embryonic cells / 細胞株 (発現宿主): HEK293S GnTI- / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: O15399 Homo sapiens (ヒト) / 参照: UniProt: O15399 |
|---|
-糖 , 2種, 14分子 
| #3: 多糖 | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose #5: 糖 | ChemComp-NAG / |
|---|
-非ポリマー , 2種, 4分子 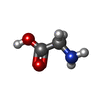
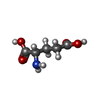

| #4: 化合物 | | #6: 化合物 | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: NMDA receptor with NMDA 1 incorperated with NMDA 2D / タイプ: COMPLEX / Entity ID: #1-#2 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 384.54 kDa/nm / 実験値: NO |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 株: Homo sapiens / 細胞内の位置: plasma membrane / 器官: brain / Organelle: synapse / 組織: brain Homo sapiens (ヒト) / 株: Homo sapiens / 細胞内の位置: plasma membrane / 器官: brain / Organelle: synapse / 組織: brain |
| 由来(組換発現) | 生物種:  Homo sapiens (ヒト) / 株: Homo sapiens / 細胞: Kidney embryonic cells / プラスミド: pEG-BacMam Homo sapiens (ヒト) / 株: Homo sapiens / 細胞: Kidney embryonic cells / プラスミド: pEG-BacMam |
| 緩衝液 | pH: 8 |
| 試料 | 濃度: 4 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES / 詳細: This sample was monodisperse |
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 281 K / 詳細: Blot for 3 seconds before plunging |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 1500 nm |
| 撮影 | 電子線照射量: 60 e/Å2 / 検出モード: SUPER-RESOLUTION フィルム・検出器のモデル: DIRECT ELECTRON DE-10 (5k x 4k) 撮影したグリッド数: 1 / 実像数: 3840 |
| 画像スキャン | 動画フレーム数/画像: 40 / 利用したフレーム数/画像: 1-40 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.20.1_4487: / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 505204 | ||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C2 (2回回転対称) | ||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 232194 / クラス平均像の数: 2 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | B value: 220 / プロトコル: FLEXIBLE FIT / 空間: REAL / Target criteria: Correlation coefficient | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 6WI1 Accession code: 6WI1 / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj















