+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7usc | ||||||
|---|---|---|---|---|---|---|---|
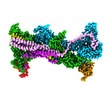
| タイトル | Cryo-EM structure of WAVE Regulatory Complex | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | CELL INVASION / actin regulator / GTPase binding protein / cytoskeletal regulator | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報peripheral region of growth cone / negative regulation of synaptic vesicle recycling / SCAR complex / positive regulation of neurotrophin TRK receptor signaling pathway / lamellipodium morphogenesis / positive regulation of Arp2/3 complex-mediated actin nucleation / Arp2/3 complex binding / modification of synaptic structure / regulation of actin polymerization or depolymerization / central region of growth cone ...peripheral region of growth cone / negative regulation of synaptic vesicle recycling / SCAR complex / positive regulation of neurotrophin TRK receptor signaling pathway / lamellipodium morphogenesis / positive regulation of Arp2/3 complex-mediated actin nucleation / Arp2/3 complex binding / modification of synaptic structure / regulation of actin polymerization or depolymerization / central region of growth cone / modification of postsynaptic actin cytoskeleton / dendrite extension / regulation of translation at postsynapse, modulating synaptic transmission / filopodium tip / regulation of modification of postsynaptic actin cytoskeleton / regulation of actin filament polymerization / RNA 7-methylguanosine cap binding / ruffle organization / cell projection assembly / axon extension / positive regulation of ruffle assembly / positive regulation of dendrite development / lamellipodium assembly / regulation of myelination / protein kinase A binding / cortical actin cytoskeleton organization / positive regulation of actin filament polymerization / Rac protein signal transduction / protein kinase A regulatory subunit binding / filamentous actin / dendritic growth cone / lamellipodium membrane / excitatory synapse / RHOG GTPase cycle / RAC2 GTPase cycle / RHO GTPases Activate WASPs and WAVEs / RAC3 GTPase cycle / positive regulation of axon extension / axonal growth cone / positive regulation of lamellipodium assembly / response to electrical stimulus / translation repressor activity / ruffle / cellular response to brain-derived neurotrophic factor stimulus / RAC1 GTPase cycle / actin filament polymerization / neuron projection morphogenesis / receptor-mediated endocytosis / mitochondrion organization / filopodium / central nervous system development / axon guidance / actin filament organization / cell motility / FCGR3A-mediated phagocytosis / positive regulation of protein-containing complex assembly / cell morphogenesis / terminal bouton / Regulation of actin dynamics for phagocytic cup formation / cognition / small GTPase binding / VEGFA-VEGFR2 Pathway / specific granule lumen / cellular response to insulin stimulus / positive regulation of fibroblast proliferation / actin filament binding / actin cytoskeleton / cell migration / tertiary granule lumen / lamellipodium / regulation of translation / actin binding / regulation of cell shape / fibroblast proliferation / actin cytoskeleton organization / protein-containing complex assembly / secretory granule lumen / in utero embryonic development / postsynapse / mitochondrial outer membrane / dendritic spine / cytoskeleton / neuron projection / intracellular membrane-bounded organelle / focal adhesion / neuronal cell body / synapse / Neutrophil degranulation / protein-containing complex binding / apoptotic process / perinuclear region of cytoplasm / protein-containing complex / extracellular exosome / extracellular region / nucleoplasm / identical protein binding / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3 Å | ||||||
 データ登録者 データ登録者 | Ding, B. / Yang, S. / Chen, B. / Chowdhury, S. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Structures reveal a key mechanism of WAVE regulatory complex activation by Rac1 GTPase. 著者: Bojian Ding / Sheng Yang / Matthias Schaks / Yijun Liu / Abbigale J Brown / Klemens Rottner / Saikat Chowdhury / Baoyu Chen /    要旨: The Rho-family GTPase Rac1 activates the WAVE regulatory complex (WRC) to drive Arp2/3 complex-mediated actin polymerization in many essential processes. Rac1 binds to WRC at two distinct sites-the ...The Rho-family GTPase Rac1 activates the WAVE regulatory complex (WRC) to drive Arp2/3 complex-mediated actin polymerization in many essential processes. Rac1 binds to WRC at two distinct sites-the A and D sites. Precisely how Rac1 binds and how the binding triggers WRC activation remain unknown. Here we report WRC structures by itself, and when bound to single or double Rac1 molecules, at ~3 Å resolutions by cryogenic-electron microscopy. The structures reveal that Rac1 binds to the two sites by distinct mechanisms, and binding to the A site, but not the D site, drives WRC activation. Activation involves a series of unique conformational changes leading to the release of sequestered WCA (WH2-central-acidic) polypeptide, which stimulates the Arp2/3 complex to polymerize actin. Together with biochemical and cellular analyses, the structures provide a novel mechanistic understanding of how the Rac1-WRC-Arp2/3-actin signaling axis is regulated in diverse biological processes and diseases. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7usc.cif.gz 7usc.cif.gz | 486.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7usc.ent.gz pdb7usc.ent.gz | 389.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7usc.json.gz 7usc.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/us/7usc https://data.pdbj.org/pub/pdb/validation_reports/us/7usc ftp://data.pdbj.org/pub/pdb/validation_reports/us/7usc ftp://data.pdbj.org/pub/pdb/validation_reports/us/7usc | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  26732MC  7usdC  7useC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 145363.750 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: This construct contains two additional uncleaved residues "GA" in the N terminus from the construct design and purification procedure. Densities for these residues are not observed in the map ...詳細: This construct contains two additional uncleaved residues "GA" in the N terminus from the construct design and purification procedure. Densities for these residues are not observed in the map and were not included in the sample sequence to avoid numbering shifts. 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CYFIP1, KIAA0068 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CYFIP1, KIAA0068 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q7L576 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q7L576 |
|---|---|
| #2: タンパク質 | 分子量: 128940.727 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: This construct contains two additional uncleaved residues "GA" in the N terminus from the construct design and purification procedure. Densities for these residues are not observed in the map ...詳細: This construct contains two additional uncleaved residues "GA" in the N terminus from the construct design and purification procedure. Densities for these residues are not observed in the map and were not included in the sample sequence to avoid numbering shifts. 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: NCKAP1, HEM2, KIAA0587, NAP1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: NCKAP1, HEM2, KIAA0587, NAP1 / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9Y2A7 Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: Q9Y2A7 |
| #3: タンパク質 | 分子量: 37009.406 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: Residues 231-248 are inserted as a flexible linker sequence. This construct contains two additional uncleaved residues "GA" in the N terminus from the construct design and purification ...詳細: Residues 231-248 are inserted as a flexible linker sequence. This construct contains two additional uncleaved residues "GA" in the N terminus from the construct design and purification procedure. Densities for these residues are not observed in the map and were not included in the sample sequence to avoid numbering shifts. 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: WASF1, KIAA0269, SCAR1, WAVE1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: WASF1, KIAA0269, SCAR1, WAVE1 / 発現宿主:  |
| #4: タンパク質 | 分子量: 8756.915 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: This construct contains uncleaved residues "GHMGAA" in the N terminus from the construct design and purification procedure. Densities for the residues are not observed in the map and were not ...詳細: This construct contains uncleaved residues "GHMGAA" in the N terminus from the construct design and purification procedure. Densities for the residues are not observed in the map and were not included in the sample sequence to avoid numbering shifts. 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: BRK1, C3orf10, HSPC300, MDS027 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: BRK1, C3orf10, HSPC300, MDS027 / 発現宿主:  |
| #5: タンパク質 | 分子量: 18041.482 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: The sequence only contains residues 1-158. Also, there are two additional uncleaved residues "GH" in the N terminus from the construct design and purification procedure. Densities for these ...詳細: The sequence only contains residues 1-158. Also, there are two additional uncleaved residues "GH" in the N terminus from the construct design and purification procedure. Densities for these residues are not observed in the map and were not included in the sample sequence to avoid numbering shifts. 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: ABI2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: ABI2 / 発現宿主:  |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: WAVE regulatory complex / タイプ: COMPLEX / Entity ID: all / 由来: MULTIPLE SOURCES | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.34 MDa / 実験値: NO | ||||||||||||
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 由来(組換発現) |
| ||||||||||||
| 緩衝液 | pH: 7 | ||||||||||||
| 試料 | 濃度: 0.41 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||
| 試料支持 | 詳細: 30 mA / グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: UltrAuFoil R1.2/1.3 | ||||||||||||
| 急速凍結 | 装置: HOMEMADE PLUNGER / 凍結剤: ETHANE / 湿度: 95 % / 凍結前の試料温度: 277.15 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TALOS ARCTICA 詳細: Data were collected by shifting the stage to the target exposure positions. |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 120000 X / 最大 デフォーカス(公称値): 1200 nm / 最小 デフォーカス(公称値): 600 nm / Cs: 2.7 mm / C2レンズ絞り径: 50 µm / アライメント法: BASIC |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 40 sec. / 電子線照射量: 44.06 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 撮影したグリッド数: 1 / 実像数: 2913 詳細: Each micrograph was acquired as dose-fractionated movies consisting of 62 frames per movie. |
| 画像スキャン | サンプリングサイズ: 14 µm / 横: 4096 / 縦: 4096 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | 詳細: Particles were CTF-corrected during projection matching and back projection タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 2006821 | ||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 95319 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 |
|
 ムービー
ムービー コントローラー
コントローラー




 PDBj
PDBj





