+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7tyt | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the pancreatic ATP-sensitive potassium channel bound to ATP and repaglinide with Kir6.2-CTD in the down conformation | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | MEMBRANE PROTEIN / KATP channel / SUR1 / Kir6.2 / repaglinide / RPG / sulfonylurea receptor / potassium transport | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Regulation of insulin secretion / ATP sensitive Potassium channels / ABC-family proteins mediated transport / response to resveratrol / ATP-activated inward rectifier potassium channel activity / inward rectifying potassium channel / sulfonylurea receptor activity / cell body fiber / ventricular cardiac muscle tissue development / CAMKK-AMPK signaling cascade ...Regulation of insulin secretion / ATP sensitive Potassium channels / ABC-family proteins mediated transport / response to resveratrol / ATP-activated inward rectifier potassium channel activity / inward rectifying potassium channel / sulfonylurea receptor activity / cell body fiber / ventricular cardiac muscle tissue development / CAMKK-AMPK signaling cascade / voltage-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / ATPase-coupled monoatomic cation transmembrane transporter activity / inward rectifier potassium channel activity / regulation of monoatomic ion transmembrane transport / nervous system process / inorganic cation transmembrane transport / response to stress / ankyrin binding / Ion homeostasis / response to ATP / action potential / potassium ion import across plasma membrane / response to testosterone / voltage-gated potassium channel activity / intercalated disc / potassium channel activity / axolemma / ABC-type transporter activity / negative regulation of insulin secretion / cellular response to nutrient levels / heat shock protein binding / T-tubule / potassium ion transmembrane transport / regulation of insulin secretion / acrosomal vesicle / regulation of membrane potential / determination of adult lifespan / response to ischemia / positive regulation of protein localization to plasma membrane / cellular response to glucose stimulus / potassium ion transport / sarcolemma / cellular response to nicotine / glucose metabolic process / cellular response to tumor necrosis factor / nuclear envelope / response to estradiol / presynaptic membrane / transmembrane transporter binding / response to hypoxia / endosome / response to xenobiotic stimulus / neuronal cell body / glutamatergic synapse / apoptotic process / ATP hydrolysis activity / protein-containing complex / ATP binding / plasma membrane / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |   Cricetus cricetus (クロハラハムスクー) Cricetus cricetus (クロハラハムスクー) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å | ||||||
 データ登録者 データ登録者 | Shyng, S.L. / Sung, M.W. / Driggers, C.M. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: J Mol Biol / 年: 2022 ジャーナル: J Mol Biol / 年: 2022タイトル: Ligand-mediated Structural Dynamics of a Mammalian Pancreatic K Channel. 著者: Min Woo Sung / Camden M Driggers / Barmak Mostofian / John D Russo / Bruce L Patton / Daniel M Zuckerman / Show-Ling Shyng /  要旨: Regulation of pancreatic K channels involves orchestrated interactions of their subunits, Kir6.2 and SUR1, and ligands. Previously we reported K channel cryo-EM structures in the presence and absence ...Regulation of pancreatic K channels involves orchestrated interactions of their subunits, Kir6.2 and SUR1, and ligands. Previously we reported K channel cryo-EM structures in the presence and absence of pharmacological inhibitors and ATP, focusing on the mechanisms by which inhibitors act as pharmacological chaperones of K channels (Martin et al., 2019). Here we analyzed the same cryo-EM datasets with a focus on channel conformational dynamics to elucidate structural correlates pertinent to ligand interactions and channel gating. We found pharmacological inhibitors and ATP enrich a channel conformation in which the Kir6.2 cytoplasmic domain is closely associated with the transmembrane domain, while depleting one where the Kir6.2 cytoplasmic domain is extended away into the cytoplasm. This conformational change remodels a network of intra- and inter-subunit interactions as well as the ATP and PIP binding pockets. The structures resolved key contacts between the distal N-terminus of Kir6.2 and SUR1's ABC module involving residues implicated in channel function and showed a SUR1 residue, K134, participates in PIP binding. Molecular dynamics simulations revealed two Kir6.2 residues, K39 and R54, that mediate both ATP and PIP binding, suggesting a mechanism for competitive gating by ATP and PIP. #1:  ジャーナル: Elife / 年: 2019 ジャーナル: Elife / 年: 2019タイトル: Mechanism of pharmacochaperoning in a mammalian K channel revealed by cryo-EM. 著者: Gregory M Martin / Min Woo Sung / Zhongying Yang / Laura M Innes / Balamurugan Kandasamy / Larry L David / Craig Yoshioka / Show-Ling Shyng /  要旨: ATP-sensitive potassium (K) channels composed of a pore-forming Kir6.2 potassium channel and a regulatory ABC transporter sulfonylurea receptor 1 (SUR1) regulate insulin secretion in pancreatic β- ...ATP-sensitive potassium (K) channels composed of a pore-forming Kir6.2 potassium channel and a regulatory ABC transporter sulfonylurea receptor 1 (SUR1) regulate insulin secretion in pancreatic β-cells to maintain glucose homeostasis. Mutations that impair channel folding or assembly prevent cell surface expression and cause congenital hyperinsulinism. Structurally diverse K inhibitors are known to act as pharmacochaperones to correct mutant channel expression, but the mechanism is unknown. Here, we compare cryoEM structures of a mammalian K channel bound to pharmacochaperones glibenclamide, repaglinide, and carbamazepine. We found all three drugs bind within a common pocket in SUR1. Further, we found the N-terminus of Kir6.2 inserted within the central cavity of the SUR1 ABC core, adjacent the drug binding pocket. The findings reveal a common mechanism by which diverse compounds stabilize the Kir6.2 N-terminus within SUR1's ABC core, allowing it to act as a firm 'handle' for the assembly of metastable mutant SUR1-Kir6.2 complexes. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7tyt.cif.gz 7tyt.cif.gz | 561.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7tyt.ent.gz pdb7tyt.ent.gz | 377.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7tyt.json.gz 7tyt.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ty/7tyt https://data.pdbj.org/pub/pdb/validation_reports/ty/7tyt ftp://data.pdbj.org/pub/pdb/validation_reports/ty/7tyt ftp://data.pdbj.org/pub/pdb/validation_reports/ty/7tyt | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  26194MC  7tysC  7u1eC  7u1qC  7u1sC  7u24C  7u2xC  7u6yC  7u7mC  7uaaC  7uqrC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 2種, 5分子 ABCDE
| #1: タンパク質 | 分子量: 43661.762 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)   #2: タンパク質 | | 分子量: 177333.578 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  Cricetus cricetus (クロハラハムスクー) Cricetus cricetus (クロハラハムスクー)遺伝子: ABCC8, SUR / 細胞株 (発現宿主): INS - 1 CELLS CLONE 832/13 / 発現宿主:  |
|---|
-糖 , 1種, 1分子
| #3: 多糖 | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose |
|---|
-非ポリマー , 6種, 20分子 




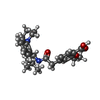





| #4: 化合物 | ChemComp-ATP / #5: 化合物 | ChemComp-K / | #6: 化合物 | ChemComp-POV / ( #7: 化合物 | #8: 化合物 | ChemComp-PTY / #9: 化合物 | ChemComp-BJX / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 由来(天然) |
| ||||||||||||||||||||||||||||
| 由来(組換発現) |
| ||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 | ||||||||||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||||||
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2600 nm / 最小 デフォーカス(公称値): 1000 nm / Cs: 2.7 mm |
| 撮影 | 電子線照射量: 40 e/Å2 フィルム・検出器のモデル: FEI FALCON III (4k x 4k) |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 36042 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 |
| ||||||||||||||||||||||||
| 精密化 | 交差検証法: NONE 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2 | ||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 53.08 Å2 | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj










