+ データを開く
データを開く
- 基本情報
基本情報
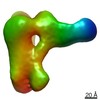
| 登録情報 | データベース: PDB / ID: 6sof | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | human insulin receptor ectodomain bound by 4 insulin | |||||||||||||||
 要素 要素 |
| |||||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN / cell surface receptor / insulin / tyrosine kinase receptor / glucose homeostasis / hormone / diabetes | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of female gonad development / positive regulation of meiotic cell cycle / insulin-like growth factor II binding / positive regulation of developmental growth / male sex determination / insulin receptor complex / positive regulation of protein-containing complex disassembly / insulin-like growth factor I binding / insulin receptor activity / exocrine pancreas development ...regulation of female gonad development / positive regulation of meiotic cell cycle / insulin-like growth factor II binding / positive regulation of developmental growth / male sex determination / insulin receptor complex / positive regulation of protein-containing complex disassembly / insulin-like growth factor I binding / insulin receptor activity / exocrine pancreas development / dendritic spine maintenance / cargo receptor activity / insulin binding / adrenal gland development / negative regulation of glycogen catabolic process / PTB domain binding / positive regulation of nitric oxide mediated signal transduction / negative regulation of fatty acid metabolic process / neuronal cell body membrane / negative regulation of feeding behavior / Signaling by Insulin receptor / IRS activation / Insulin processing / regulation of protein secretion / positive regulation of peptide hormone secretion / positive regulation of respiratory burst / Regulation of gene expression in beta cells / negative regulation of acute inflammatory response / amyloid-beta clearance / alpha-beta T cell activation / insulin receptor substrate binding / positive regulation of receptor internalization / regulation of embryonic development / Synthesis, secretion, and deacylation of Ghrelin / positive regulation of dendritic spine maintenance / epidermis development / negative regulation of protein secretion / negative regulation of gluconeogenesis / positive regulation of glycogen biosynthetic process / fatty acid homeostasis / Signal attenuation / protein kinase activator activity / positive regulation of insulin receptor signaling pathway / FOXO-mediated transcription of oxidative stress, metabolic and neuronal genes / negative regulation of respiratory burst involved in inflammatory response / negative regulation of lipid catabolic process / positive regulation of lipid biosynthetic process / negative regulation of oxidative stress-induced intrinsic apoptotic signaling pathway / heart morphogenesis / transport across blood-brain barrier / regulation of protein localization to plasma membrane / phosphatidylinositol 3-kinase binding / transport vesicle / nitric oxide-cGMP-mediated signaling / positive regulation of nitric-oxide synthase activity / COPI-mediated anterograde transport / Insulin receptor recycling / negative regulation of reactive oxygen species biosynthetic process / positive regulation of brown fat cell differentiation / insulin-like growth factor receptor binding / NPAS4 regulates expression of target genes / neuron projection maintenance / endoplasmic reticulum-Golgi intermediate compartment membrane / positive regulation of mitotic nuclear division / dendrite membrane / receptor-mediated endocytosis / Insulin receptor signalling cascade / positive regulation of glycolytic process / positive regulation of cytokine production / endosome lumen / acute-phase response / positive regulation of long-term synaptic potentiation / positive regulation of D-glucose import across plasma membrane / positive regulation of protein secretion / learning / insulin receptor binding / positive regulation of cell differentiation / Regulation of insulin secretion / wound healing / positive regulation of neuron projection development / hormone activity / receptor protein-tyrosine kinase / negative regulation of protein catabolic process / regulation of synaptic plasticity / caveola / receptor internalization / positive regulation of protein localization to nucleus / Golgi lumen / cellular response to growth factor stimulus / vasodilation / male gonad development / cognition / memory / cellular response to insulin stimulus / glucose metabolic process / positive regulation of nitric oxide biosynthetic process / insulin receptor signaling pathway / late endosome / cell-cell signaling / glucose homeostasis 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.3 Å | |||||||||||||||
 データ登録者 データ登録者 | Gutmann, T. / Schaefer, I.B. / Poojari, C.S. / Vattulainen, I. / Strauss, M. / Coskun, U. | |||||||||||||||
| 資金援助 |  ドイツ, ドイツ,  フィンランド, 4件 フィンランド, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: J Cell Biol / 年: 2020 ジャーナル: J Cell Biol / 年: 2020タイトル: Cryo-EM structure of the complete and ligand-saturated insulin receptor ectodomain. 著者: Theresia Gutmann / Ingmar B Schäfer / Chetan Poojari / Beate Brankatschk / Ilpo Vattulainen / Mike Strauss / Ünal Coskun /    要旨: Glucose homeostasis and growth essentially depend on the hormone insulin engaging its receptor. Despite biochemical and structural advances, a fundamental contradiction has persisted in the current ...Glucose homeostasis and growth essentially depend on the hormone insulin engaging its receptor. Despite biochemical and structural advances, a fundamental contradiction has persisted in the current understanding of insulin ligand-receptor interactions. While biochemistry predicts two distinct insulin binding sites, 1 and 2, recent structural analyses have resolved only site 1. Using a combined approach of cryo-EM and atomistic molecular dynamics simulation, we present the structure of the entire dimeric insulin receptor ectodomain saturated with four insulin molecules. Complementing the previously described insulin-site 1 interaction, we present the first view of insulin bound to the discrete insulin receptor site 2. Insulin binding stabilizes the receptor ectodomain in a T-shaped conformation wherein the membrane-proximal domains converge and contact each other. These findings expand the current models of insulin binding to its receptor and of its regulation. In summary, we provide the structural basis for a comprehensive description of ligand-receptor interactions that ultimately will inform new approaches to structure-based drug design. #1:  ジャーナル: bioRxiv / 年: 2019 ジャーナル: bioRxiv / 年: 2019タイトル: Cryo-EM structure of the complete and ligand-saturated insulin receptor ectodomain 著者: Gutmann, T. / Schafer, I.B. / Poojari, C. / Brankatschk, B. / Vattulainen, I. / Strauss, M. / Coskun, U. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6sof.cif.gz 6sof.cif.gz | 627.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6sof.ent.gz pdb6sof.ent.gz | 525.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6sof.json.gz 6sof.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/so/6sof https://data.pdbj.org/pub/pdb/validation_reports/so/6sof ftp://data.pdbj.org/pub/pdb/validation_reports/so/6sof ftp://data.pdbj.org/pub/pdb/validation_reports/so/6sof | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 82551.742 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: INSR / 細胞株 (発現宿主): HEK293F / 発現宿主: Homo sapiens (ヒト) / 遺伝子: INSR / 細胞株 (発現宿主): HEK293F / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P06213, receptor protein-tyrosine kinase Homo sapiens (ヒト) / 参照: UniProt: P06213, receptor protein-tyrosine kinase#2: タンパク質 | 分子量: 18513.900 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: INSR / 細胞株 (発現宿主): HEK293F / 発現宿主: Homo sapiens (ヒト) / 遺伝子: INSR / 細胞株 (発現宿主): HEK293F / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P06213, receptor protein-tyrosine kinase Homo sapiens (ヒト) / 参照: UniProt: P06213, receptor protein-tyrosine kinase#3: タンパク質・ペプチド | 分子量: 2383.698 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: INS / 発現宿主: Homo sapiens (ヒト) / 遺伝子: INS / 発現宿主:  #4: タンパク質・ペプチド | 分子量: 3433.953 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: INS / 発現宿主: Homo sapiens (ヒト) / 遺伝子: INS / 発現宿主:  Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.375 MDa / 実験値: YES | ||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||
| 由来(組換発現) |
| ||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 | ||||||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||
| 急速凍結 | 凍結剤: ETHANE-PROPANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 10.2 sec. / 電子線照射量: 55 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 撮影したグリッド数: 1 / 実像数: 51 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 4.3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 326257 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 6CEB Accession code: 6CEB / Source name: PDB / タイプ: experimental model |
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj






















