+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6gkh | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
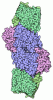
| タイトル | CryoEM structure of the MDA5-dsRNA filament in complex with ADP-AlF4 | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード | IMMUNE SYSTEM / Protein-RNA complex / helical filament / ATPase / innate immune receptor | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報MDA-5 signaling pathway / Ub-specific processing proteases / positive regulation of response to cytokine stimulus / negative regulation of viral genome replication / type I interferon-mediated signaling pathway / cellular response to exogenous dsRNA / pattern recognition receptor activity / protein complex oligomerization / positive regulation of interferon-alpha production / protein sumoylation ...MDA-5 signaling pathway / Ub-specific processing proteases / positive regulation of response to cytokine stimulus / negative regulation of viral genome replication / type I interferon-mediated signaling pathway / cellular response to exogenous dsRNA / pattern recognition receptor activity / protein complex oligomerization / positive regulation of interferon-alpha production / protein sumoylation / ribonucleoprotein complex binding / antiviral innate immune response / positive regulation of interferon-beta production / response to virus / positive regulation of interleukin-6 production / cellular response to virus / positive regulation of tumor necrosis factor production / double-stranded RNA binding / defense response to virus / single-stranded RNA binding / RNA helicase activity / RNA helicase / protein domain specific binding / chromatin extrusion motor activity / ATP-dependent H2AZ histone chaperone activity / ATP-dependent H3-H4 histone complex chaperone activity / cohesin loader activity / DNA clamp loader activity / innate immune response / ATP hydrolysis activity / mitochondrion / DNA binding / zinc ion binding / ATP binding / identical protein binding / nucleus / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |   Pseudomonas phage phi6 (ファージ) Pseudomonas phage phi6 (ファージ) | |||||||||
| 手法 | 電子顕微鏡法 / らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 4.06 Å | |||||||||
 データ登録者 データ登録者 | Yu, Q. / Qu, K. / Modis, Y. | |||||||||
| 資金援助 |  英国, 2件 英国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2018 ジャーナル: Mol Cell / 年: 2018タイトル: Cryo-EM Structures of MDA5-dsRNA Filaments at Different Stages of ATP Hydrolysis. 著者: Qin Yu / Kun Qu / Yorgo Modis /  要旨: Double-stranded RNA (dsRNA) is a potent proinflammatory signature of viral infection. Long cytosolic dsRNA is recognized by MDA5. The cooperative assembly of MDA5 into helical filaments on dsRNA ...Double-stranded RNA (dsRNA) is a potent proinflammatory signature of viral infection. Long cytosolic dsRNA is recognized by MDA5. The cooperative assembly of MDA5 into helical filaments on dsRNA nucleates the assembly of a multiprotein type I interferon signaling platform. Here, we determined cryoelectron microscopy (cryo-EM) structures of MDA5-dsRNA filaments with different helical twists and bound nucleotide analogs at resolutions sufficient to build and refine atomic models. The structures identify the filament-forming interfaces, which encode the dsRNA binding cooperativity and length specificity of MDA5. The predominantly hydrophobic interface contacts confer flexibility, reflected in the variable helical twist within filaments. Mutation of filament-forming residues can result in loss or gain of signaling activity. Each MDA5 molecule spans 14 or 15 RNA base pairs, depending on the twist. Variations in twist also correlate with variations in the occupancy and type of nucleotide in the active site, providing insights on how ATP hydrolysis contributes to MDA5-dsRNA recognition. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6gkh.cif.gz 6gkh.cif.gz | 246.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6gkh.ent.gz pdb6gkh.ent.gz | 188.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6gkh.json.gz 6gkh.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6gkh_validation.pdf.gz 6gkh_validation.pdf.gz | 1.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6gkh_full_validation.pdf.gz 6gkh_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  6gkh_validation.xml.gz 6gkh_validation.xml.gz | 35 KB | 表示 | |
| CIF形式データ |  6gkh_validation.cif.gz 6gkh_validation.cif.gz | 53.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/gk/6gkh https://data.pdbj.org/pub/pdb/validation_reports/gk/6gkh ftp://data.pdbj.org/pub/pdb/validation_reports/gk/6gkh ftp://data.pdbj.org/pub/pdb/validation_reports/gk/6gkh | HTTPS FTP |
-関連構造データ
| 関連構造データ |  0023MC  0012C  0024C  0143C  0145C  4338C  4340C  4341C  6g19C  6g1sC  6g1xC  6gjzC  6gkmC  6h61C  6h66C C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10211 (タイトル: mouse MDA5-dsRNA filamemts in complex of 2mM ADP-AlF4 EMPIAR-10211 (タイトル: mouse MDA5-dsRNA filamemts in complex of 2mM ADP-AlF4Data size: 195.3 Data #1: mouse MDA5-dsRNA filaments in complex with 2mM ADP-AlF4_data1 [micrographs - single frame] Data #2: mouse MDA5-dsRNA filaments in complex with 2mM ADP-AlF4_data2_rescaled [micrographs - single frame] Data #3: mouse MDA5-dsRNA filaments in complex with 2mM ADP-AlF4_data2 [micrographs - single frame]) |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 1種, 1分子 A
| #1: タンパク質 | 分子量: 114214.477 Da / 分子数: 1 / 変異: Residues 646-663 deleted / 由来タイプ: 組換発現 / 由来: (組換発現)   |
|---|
-RNA鎖 , 2種, 2分子 XY
| #2: RNA鎖 | 分子量: 4894.018 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)  Pseudomonas phage phi6 (ファージ) Pseudomonas phage phi6 (ファージ) |
|---|---|
| #3: RNA鎖 | 分子量: 4681.785 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)  Pseudomonas phage phi6 (ファージ) Pseudomonas phage phi6 (ファージ) |
-非ポリマー , 4種, 4分子 
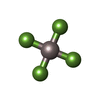


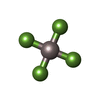


| #4: 化合物 | ChemComp-ADP / |
|---|---|
| #5: 化合物 | ChemComp-ALF / |
| #6: 化合物 | ChemComp-MG / |
| #7: 化合物 | ChemComp-ZN / |
-詳細
| Has protein modification | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: HELICAL ARRAY / 3次元再構成法: らせん対称体再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 |
| ||||||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||||||
| 由来(組換発現) | 生物種:  | ||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.7 | ||||||||||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||||||||||
| 試料 | 濃度: 0.5 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES 詳細: Samples were diluted twofold from 1 mg/ml to 0.5 mg/ml immediately prior to plunge freezing | ||||||||||||||||||||||||||||
| 試料支持 | 詳細: 25 mA / グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | ||||||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(補正後): 75000 X / 最大 デフォーカス(公称値): -2700 nm / 最小 デフォーカス(公称値): -1800 nm / アライメント法: ZEMLIN TABLEAU |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 29.85 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: FEI FALCON III (4k x 4k) |
| 画像スキャン | 横: 4096 / 縦: 4096 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| らせん対称 | 回転角度/サブユニット: 87.8315 ° / 軸方向距離/サブユニット: 46.5105 Å / らせん対称軸の対称性: C1 | ||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 234835 | ||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 4.06 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 31556 / アルゴリズム: FOURIER SPACE / クラス平均像の数: 1 / 対称性のタイプ: HELICAL | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | B value: 175 / プロトコル: FLEXIBLE FIT / 空間: REAL / Target criteria: Cross-correlation coefficient |
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj