+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 6ejf | ||||||
|---|---|---|---|---|---|---|---|
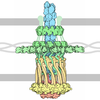
| Title | Thermus thermophilus PilF ATPase (apoprotein form) | ||||||
 Components Components | (Type IV pilus assembly protein PilF) x 3 | ||||||
 Keywords Keywords | MOTOR PROTEIN / type IV pilus / type II secretion / macromolecular machine | ||||||
| Function / homology |  Function and homology information Function and homology informationATP hydrolysis activity / ATP binding / metal ion binding / plasma membrane / cytoplasm Similarity search - Function | ||||||
| Biological species |   Thermus thermophilus (bacteria) Thermus thermophilus (bacteria) | ||||||
| Method | ELECTRON MICROSCOPY / single particle reconstruction / cryo EM / Resolution: 8 Å | ||||||
 Authors Authors | Derrick, J.P. / Collins, R.F. | ||||||
 Citation Citation |  Journal: Sci Rep / Year: 2018 Journal: Sci Rep / Year: 2018Title: Structural cycle of the Thermus thermophilus PilF ATPase: the powering of type IVa pilus assembly. Authors: Richard Collins / Vijaykumar Karuppiah / C Alistair Siebert / Rana Dajani / Angela Thistlethwaite / Jeremy P Derrick /  Abstract: Type IV pili are responsible for a diverse range of functions, including twitching motility and cell adhesion. Assembly of the pilus fiber is driven by a cytoplasmic ATPase: it interacts with an ...Type IV pili are responsible for a diverse range of functions, including twitching motility and cell adhesion. Assembly of the pilus fiber is driven by a cytoplasmic ATPase: it interacts with an inner membrane complex of biogenesis proteins which, in turn, bind to nascent pilin subunits and mediate fiber assembly. Here we report the structural characterization of the PilF TFP assembly ATPase from Thermus thermophilus. The crystal structure of a recombinant C-terminal fragment of PilF revealed bound, unhydrolysed ATP, although the full length complex was enzymatically active. 3D reconstructions were carried out by single particle cryoelectron microscopy for full length apoprotein PilF and in complex with AMPPNP. The structure forms an hourglass-like shape, with the ATPase domains in one half and the N1 domains in the second half which, we propose, interact with the other pilus biogenesis components. Molecular models for both forms were generated: binding of AMPPNP causes an upward shift of the N1 domains towards the ATPase domains of ~8 Å. We advocate a model in which ATP hydrolysis is linked to displacement of the N1 domains which is associated with lifting pilin subunits out of the inner membrane, and provide the activation energy needed to form the pilus fiber. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Movie |
 Movie viewer Movie viewer |
|---|---|
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  6ejf.cif.gz 6ejf.cif.gz | 657.9 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb6ejf.ent.gz pdb6ejf.ent.gz | 526 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  6ejf.json.gz 6ejf.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/ej/6ejf https://data.pdbj.org/pub/pdb/validation_reports/ej/6ejf ftp://data.pdbj.org/pub/pdb/validation_reports/ej/6ejf ftp://data.pdbj.org/pub/pdb/validation_reports/ej/6ejf | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  3882MC  4194C  5oiuC  6f8lC M: map data used to model this data C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 |
|
- Components
Components
| #1: Protein | Mass: 16249.751 Da / Num. of mol.: 6 / Fragment: UNP residues 330-475 Source method: isolated from a genetically manipulated source Details: Domain is part of the larger protein but connectivity to other domains cannot be confirmed. Source: (gene. exp.)   Thermus thermophilus (strain HB8 / ATCC 27634 / DSM 579) (bacteria) Thermus thermophilus (strain HB8 / ATCC 27634 / DSM 579) (bacteria)Strain: HB8 / ATCC 27634 / DSM 579 / Gene: TTHA0364 / Production host:  #2: Protein | Mass: 15440.708 Da / Num. of mol.: 6 / Fragment: UNP residues 163-299 Source method: isolated from a genetically manipulated source Details: Domain is part of the larger protein but connectivity to other domains cannot be confirmed. Source: (gene. exp.)   Thermus thermophilus (strain HB8 / ATCC 27634 / DSM 579) (bacteria) Thermus thermophilus (strain HB8 / ATCC 27634 / DSM 579) (bacteria)Strain: HB8 / ATCC 27634 / DSM 579 / Gene: TTHA0364 / Production host:  #3: Protein | Mass: 45203.906 Da / Num. of mol.: 6 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   Thermus thermophilus (strain HB8 / ATCC 27634 / DSM 579) (bacteria) Thermus thermophilus (strain HB8 / ATCC 27634 / DSM 579) (bacteria)Strain: HB8 / ATCC 27634 / DSM 579 / Gene: TTHA0364 / Production host:  Has protein modification | Y | |
|---|
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: PARTICLE / 3D reconstruction method: single particle reconstruction |
- Sample preparation
Sample preparation
| Component | Name: Thermus thermophilus PilF ATPase (AMPPNP-bound form) / Type: COMPLEX / Entity ID: all / Source: RECOMBINANT |
|---|---|
| Molecular weight | Experimental value: NO |
| Source (natural) | Organism:   Thermus thermophilus HB8 (bacteria) Thermus thermophilus HB8 (bacteria) |
| Source (recombinant) | Organism:  |
| Buffer solution | pH: 7.5 Details: 25 mM HEPES pH 7.5, 150 mM NaCl, 5 mM MgCl2 and 5 % glycerol (v/v) |
| Specimen | Conc.: 0.2 mg/ml / Embedding applied: NO / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES / Details: Monodisperse |
| Vitrification | Cryogen name: ETHANE |
- Electron microscopy imaging
Electron microscopy imaging
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
|---|---|
| Microscopy | Model: FEI TITAN KRIOS |
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: OTHER FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: OTHER |
| Electron lens | Mode: OTHER / Nominal defocus max: 4500 nm / Nominal defocus min: 1000 nm / Calibrated defocus min: 1000 nm / Calibrated defocus max: 4500 nm / Cs: 2.7 mm / Alignment procedure: COMA FREE |
| Specimen holder | Cryogen: NITROGEN / Specimen holder model: FEI TITAN KRIOS AUTOGRID HOLDER |
| Image recording | Electron dose: 45 e/Å2 / Film or detector model: GATAN K2 BASE (4k x 4k) |
- Processing
Processing
| CTF correction | Type: PHASE FLIPPING AND AMPLITUDE CORRECTION |
|---|---|
| 3D reconstruction | Resolution: 8 Å / Resolution method: FSC 0.5 CUT-OFF / Num. of particles: 45000 / Symmetry type: POINT |
| Atomic model building | Protocol: FLEXIBLE FIT / Space: REAL |
 Movie
Movie Controller
Controller








 PDBj
PDBj