[English] 日本語
 Yorodumi
Yorodumi- PDB-3iyl: Atomic CryoEM Structure of a Nonenveloped Virus Suggests How Memb... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 3iyl | ||||||
|---|---|---|---|---|---|---|---|
| Title | Atomic CryoEM Structure of a Nonenveloped Virus Suggests How Membrane Penetration Protein is Primed for Cell Entry | ||||||
 Components Components |
| ||||||
 Keywords Keywords | VIRUS / Non-enveloped virus / Membrane penetration protein / Autocleavage / Myristol Group / Icosahedral virus | ||||||
| Function / homology |  Function and homology information Function and homology informationsymbiont entry into host cell via permeabilization of inner membrane / permeabilization of host organelle membrane involved in viral entry into host cell / host cell surface binding / viral inner capsid / viral outer capsid / 7-methylguanosine mRNA capping / viral capsid / mRNA guanylyltransferase activity / mRNA 5'-cap (guanine-N7-)-methyltransferase activity / RNA helicase activity ...symbiont entry into host cell via permeabilization of inner membrane / permeabilization of host organelle membrane involved in viral entry into host cell / host cell surface binding / viral inner capsid / viral outer capsid / 7-methylguanosine mRNA capping / viral capsid / mRNA guanylyltransferase activity / mRNA 5'-cap (guanine-N7-)-methyltransferase activity / RNA helicase activity / hydrolase activity / RNA helicase / GTP binding / ATP binding / metal ion binding Similarity search - Function | ||||||
| Biological species |  Grass carp reovirus Grass carp reovirus | ||||||
| Method | ELECTRON MICROSCOPY / single particle reconstruction / cryo EM / Resolution: 3.3 Å | ||||||
 Authors Authors | Zhang, X. / Jin, L. / Fang, Q. / Hui, W. / Zhou, Z.H. | ||||||
 Citation Citation |  Journal: Cell / Year: 2010 Journal: Cell / Year: 2010Title: 3.3 A cryo-EM structure of a nonenveloped virus reveals a priming mechanism for cell entry. Authors: Xing Zhang / Lei Jin / Qin Fang / Wong H Hui / Z Hong Zhou /  Abstract: To achieve cell entry, many nonenveloped viruses must transform from a dormant to a primed state. In contrast to the membrane fusion mechanism of enveloped viruses (e.g., influenza virus), this ...To achieve cell entry, many nonenveloped viruses must transform from a dormant to a primed state. In contrast to the membrane fusion mechanism of enveloped viruses (e.g., influenza virus), this membrane penetration mechanism is poorly understood. Here, using single-particle cryo-electron microscopy, we report a 3.3 A structure of the primed, infectious subvirion particle of aquareovirus. The density map reveals side-chain densities of all types of amino acids (except glycine), enabling construction of a full-atom model of the viral particle. Our structure and biochemical results show that priming involves autocleavage of the membrane penetration protein and suggest that Lys84 and Glu76 may facilitate this autocleavage in a nucleophilic attack. We observe a myristoyl group, covalently linked to the N terminus of the penetration protein and embedded in a hydrophobic pocket. These results suggest a well-orchestrated process of nonenveloped virus entry involving autocleavage of the penetration protein prior to exposure of its membrane-insertion finger. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Movie |
 Movie viewer Movie viewer |
|---|---|
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  3iyl.cif.gz 3iyl.cif.gz | 1.8 MB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb3iyl.ent.gz pdb3iyl.ent.gz | 1.5 MB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  3iyl.json.gz 3iyl.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/iy/3iyl https://data.pdbj.org/pub/pdb/validation_reports/iy/3iyl ftp://data.pdbj.org/pub/pdb/validation_reports/iy/3iyl ftp://data.pdbj.org/pub/pdb/validation_reports/iy/3iyl | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  5160MC M: map data used to model this data C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 | x 60
|
| 2 |
|
| 3 | x 5
|
| 4 | x 6
|
| 5 | 
|
| Symmetry | Point symmetry: (Schoenflies symbol: I (icosahedral)) |
- Components
Components
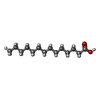
| #1: Protein | Mass: 68646.750 Da / Num. of mol.: 20 / Source method: isolated from a natural source / Source: (natural)  Grass carp reovirus / References: UniProt: Q8JU67 Grass carp reovirus / References: UniProt: Q8JU67#2: Protein | Mass: 44606.535 Da / Num. of mol.: 2 / Source method: isolated from a natural source / Source: (natural)  Grass carp reovirus / References: UniProt: Q8JU64 Grass carp reovirus / References: UniProt: Q8JU64#3: Protein | | Mass: 141512.156 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  Grass carp reovirus / References: UniProt: Q9E3W0 Grass carp reovirus / References: UniProt: Q9E3W0#4: Protein | Mass: 132203.312 Da / Num. of mol.: 2 / Source method: isolated from a natural source / Source: (natural)  Grass carp reovirus / References: UniProt: Q9E3V8 Grass carp reovirus / References: UniProt: Q9E3V8#5: Chemical | ChemComp-MYR / Has protein modification | Y | |
|---|
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: PARTICLE / 3D reconstruction method: single particle reconstruction |
- Sample preparation
Sample preparation
| Component | Name: Aquareovirus / Type: VIRUS / Details: The sample was monodisperse |
|---|---|
| Molecular weight | Value: 72 MDa / Experimental value: NO |
| Details of virus | Empty: NO / Enveloped: NO / Host category: VERTEBRATES / Isolate: STRAIN / Type: VIRION |
| Buffer solution | pH: 7.5 / Details: 10mM PBS Buffer |
| Specimen | Embedding applied: NO / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES / Details: 10mM PBS Buffer |
| Vitrification | Instrument: FEI VITROBOT MARK I / Cryogen name: METHANE / Temp: 90 K / Humidity: 100 % / Method: Blot for 7-9 seconds before plunging |
- Electron microscopy imaging
Electron microscopy imaging
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
|---|---|
| Microscopy | Model: FEI TITAN KRIOS / Date: Mar 1, 2009 |
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM |
| Electron lens | Mode: BRIGHT FIELD / Nominal magnification: 59000 X / Calibrated magnification: 57700 X / Nominal defocus max: 2700 nm / Nominal defocus min: 400 nm / Cs: 2.7 mm Astigmatism: objective lens astigmatism was corrected at 250,000 times magnification Camera length: 0 mm |
| Specimen holder | Specimen holder model: OTHER / Specimen holder type: Eucentric / Temperature: 90 K / Temperature (min): 90 K / Tilt angle max: 0 ° / Tilt angle min: 0 ° |
| Image recording | Electron dose: 25 e/Å2 / Film or detector model: KODAK SO-163 FILM |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M |
| Radiation wavelength | Relative weight: 1 |
- Processing
Processing
| EM software |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF correction | Details: Each particle | ||||||||||||
| Symmetry | Point symmetry: I (icosahedral) | ||||||||||||
| 3D reconstruction | Method: Fourier Space Reconstruction / Resolution: 3.3 Å / Resolution method: FSC 0.143 CUT-OFF / Num. of particles: 18464 / Symmetry type: POINT | ||||||||||||
| Refinement step | Cycle: LAST
|
 Movie
Movie Controller
Controller










 PDBj
PDBj