+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6791 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of p300-p53 protein complex | |||||||||
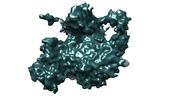
 マップデータ マップデータ | Cryo-EM map of p300-p53 complex. p53 protein is a homotetrameric tumor suppresor. Transcriptional coactivator p300 is a multidomain protein with HAT (histone acetyltransferase) activity. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | transcription factor / autoacetylation / allosteric interaction / catalytically active form / TRANSCRIPTION | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報behavioral defense response / peptidyl-lysine propionylation / histone lactyltransferase (CoA-dependent) activity / peptidyl-lysine crotonylation / peptidyl-lysine butyrylation / histone butyryltransferase activity / histone H3K122 acetyltransferase activity / swimming / peptide butyryltransferase activity / histone H2B acetyltransferase activity ...behavioral defense response / peptidyl-lysine propionylation / histone lactyltransferase (CoA-dependent) activity / peptidyl-lysine crotonylation / peptidyl-lysine butyrylation / histone butyryltransferase activity / histone H3K122 acetyltransferase activity / swimming / peptide butyryltransferase activity / histone H2B acetyltransferase activity / thigmotaxis / peptide 2-hydroxyisobutyryltransferase activity / histone crotonyltransferase activity / protein propionyltransferase activity / NOTCH2 intracellular domain regulates transcription / peptidyl-lysine acetylation / lysine N-acetyltransferase activity, acting on acetyl phosphate as donor / cellular response to L-leucine / histone H4 acetyltransferase activity / internal peptidyl-lysine acetylation / histone H3 acetyltransferase activity / NFE2L2 regulating ER-stress associated genes / peptide N-acetyltransferase activity / Activation of the TFAP2 (AP-2) family of transcription factors / NFE2L2 regulating inflammation associated genes / acetylation-dependent protein binding / NGF-stimulated transcription / STAT3 nuclear events downstream of ALK signaling / Polo-like kinase mediated events / histone H3K18 acetyltransferase activity / LRR FLII-interacting protein 1 (LRRFIP1) activates type I IFN production / N-terminal peptidyl-lysine acetylation / histone H3K27 acetyltransferase activity / NFE2L2 regulates pentose phosphate pathway genes / NFE2L2 regulating MDR associated enzymes / regulation of androgen receptor signaling pathway / positive regulation by host of viral transcription / Loss of function of TP53 in cancer due to loss of tetramerization ability / Regulation of TP53 Expression / regulation of mitochondrion organization / signal transduction by p53 class mediator / negative regulation of G1 to G0 transition / negative regulation of glucose catabolic process to lactate via pyruvate / Transcriptional activation of cell cycle inhibitor p21 / regulation of intrinsic apoptotic signaling pathway by p53 class mediator / Activation of NOXA and translocation to mitochondria / negative regulation of pentose-phosphate shunt / ATP-dependent DNA/DNA annealing activity / negative regulation of helicase activity / regulation of cell cycle G2/M phase transition / intrinsic apoptotic signaling pathway in response to hypoxia / regulation of fibroblast apoptotic process / oxidative stress-induced premature senescence / oligodendrocyte apoptotic process / negative regulation of miRNA processing / positive regulation of thymocyte apoptotic process / glucose catabolic process to lactate via pyruvate / regulation of tissue remodeling / positive regulation of mitochondrial membrane permeability / Regulation of gene expression in late stage (branching morphogenesis) pancreatic bud precursor cells / negative regulation of mitophagy / RUNX3 regulates NOTCH signaling / positive regulation of programmed necrotic cell death / face morphogenesis / mRNA transcription / bone marrow development / circadian behavior / NOTCH4 Intracellular Domain Regulates Transcription / Regulation of FOXO transcriptional activity by acetylation / histone deacetylase regulator activity / Regulation of gene expression by Hypoxia-inducible Factor / RUNX3 regulates CDKN1A transcription / regulation of glycolytic process / germ cell nucleus / regulation of mitochondrial membrane permeability involved in apoptotic process / Nuclear events mediated by NFE2L2 / regulation of DNA damage response, signal transduction by p53 class mediator / Regulation of NFE2L2 gene expression / TP53 regulates transcription of additional cell cycle genes whose exact role in the p53 pathway remain uncertain / NOTCH3 Intracellular Domain Regulates Transcription / TP53 Regulates Transcription of Death Receptors and Ligands / Activation of PUMA and translocation to mitochondria / platelet formation / DNA damage response, signal transduction by p53 class mediator resulting in transcription of p21 class mediator / NFE2L2 regulating anti-oxidant/detoxification enzymes / TRAF6 mediated IRF7 activation / megakaryocyte development / macrophage derived foam cell differentiation / FOXO-mediated transcription of cell death genes / NFE2L2 regulating tumorigenic genes / nuclear androgen receptor binding / negative regulation of glial cell proliferation / peptide-lysine-N-acetyltransferase activity / Formation of Senescence-Associated Heterochromatin Foci (SAHF) / negative regulation of neuroblast proliferation / regulation of tubulin deacetylation / STAT family protein binding / Regulation of TP53 Activity through Association with Co-factors / internal protein amino acid acetylation / mitochondrial DNA repair 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
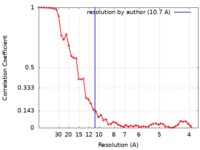
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 10.7 Å | |||||||||
 データ登録者 データ登録者 | Ghosh R / Roy S / Sengupta J | |||||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 2019 ジャーナル: Biochemistry / 年: 2019タイトル: Tumor Suppressor p53-Mediated Structural Reorganization of the Transcriptional Coactivator p300. 著者: Raka Ghosh / Stephanie Kaypee / Manidip Shasmal / Tapas K Kundu / Siddhartha Roy / Jayati Sengupta /  要旨: Transcriptional coactivator p300, a critical player in eukaryotic gene regulation, primarily functions as a histone acetyltransferase (HAT). It is also an important player in acetylation of a number ...Transcriptional coactivator p300, a critical player in eukaryotic gene regulation, primarily functions as a histone acetyltransferase (HAT). It is also an important player in acetylation of a number of nonhistone proteins, p53 being the most prominent one. Recruitment of p300 to p53 is pivotal in the regulation of p53-dependent genes. Emerging evidence suggests that p300 adopts an active conformation upon binding to the tetrameric p53, resulting in its enhanced acetylation activity. As a modular protein, p300 consists of multiple well-defined domains, where the structured domains are interlinked with unstructured linker regions. A crystal structure of the central domain of p300 encompassing Bromo, RING, PHD, and HAT domains demonstrates a compact module, where the HAT active site stays occluded by the RING domain. However, although p300 has a significant role in mediating the transcriptional activity of p53, only a few structural details on the complex of these two full-length proteins are available. Here, we present a cryo-electron microscopy (cryo-EM) study on the p300-p53 complex. The three-dimensional cryo-EM density map of the p300-p53 complex, when compared to the cryo-EM map of free p300, revealed that substantial change in the relative arrangement of Bromo and HAT domains occurs upon complex formation, which is likely required for exposing HAT active site and subsequent acetyltransferase activity. Our observation correlates well with previous studies showing that the presence of Bromodomain is obligatory for effective acetyltransferase activity of HAT. Thus, our result sheds new light on the mechanism whereby p300, following binding with p53, gets activated. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6791.map.gz emd_6791.map.gz | 7.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6791-v30.xml emd-6791-v30.xml emd-6791.xml emd-6791.xml | 15.1 KB 15.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_6791_fsc.xml emd_6791_fsc.xml | 5.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_6791.png emd_6791.png | 153.5 KB | ||
| Filedesc metadata |  emd-6791.cif.gz emd-6791.cif.gz | 6.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6791 http://ftp.pdbj.org/pub/emdb/structures/EMD-6791 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6791 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6791 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_6791_validation.pdf.gz emd_6791_validation.pdf.gz | 507.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_6791_full_validation.pdf.gz emd_6791_full_validation.pdf.gz | 507.4 KB | 表示 | |
| XML形式データ |  emd_6791_validation.xml.gz emd_6791_validation.xml.gz | 8.4 KB | 表示 | |
| CIF形式データ |  emd_6791_validation.cif.gz emd_6791_validation.cif.gz | 10.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6791 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6791 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6791 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6791 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6791.map.gz / 形式: CCP4 / 大きさ: 8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6791.map.gz / 形式: CCP4 / 大きさ: 8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM map of p300-p53 complex. p53 protein is a homotetrameric tumor suppresor. Transcriptional coactivator p300 is a multidomain protein with HAT (histone acetyltransferase) activity. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.89 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
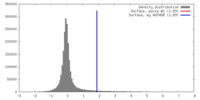
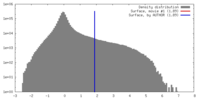
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : p300-p53 complex
| 全体 | 名称: p300-p53 complex |
|---|---|
| 要素 |
|
-超分子 #1: p300-p53 complex
| 超分子 | 名称: p300-p53 complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Proteins were purified separately and then complex was made for cryo-EM. |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Histone acetyltransferase p300
| 分子 | 名称: Histone acetyltransferase p300 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: histone acetyltransferase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 72.100062 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: KKIFKPEELR QALMPTLEAL YRQDPESLPF RQPVDPQLLG IPDYFDIVKS PMDLSTIKRK LDTGQYQEPW QYVDDIWLMF NNAWLYNRK TSRVYKYCSK LSEVFEQEID PVMQSLGYCC GRKLEFSPQT LCCYGKQLCT IPRDATYYSY QNRYHFCEKC F NEIQGESV ...文字列: KKIFKPEELR QALMPTLEAL YRQDPESLPF RQPVDPQLLG IPDYFDIVKS PMDLSTIKRK LDTGQYQEPW QYVDDIWLMF NNAWLYNRK TSRVYKYCSK LSEVFEQEID PVMQSLGYCC GRKLEFSPQT LCCYGKQLCT IPRDATYYSY QNRYHFCEKC F NEIQGESV SLGDDPSQPQ TTINKEQFSK RKNDTLDPEL FVECTECGRK MHQICVLHHE IIWPAGFVCD GCLKKSARTR KE NKFSAKR LPSTRLGTFL ENRVNDFLRR QNHPESGEVT VRVVHASDKT VEVKPGMKAR FVDSGEMAES FPYRTKALFA FEE IDGVDL CFFGMHVQEY GSDCPPPNQR RVYISYLDSV HFFRPKCLRT AVYHEILIGY LEYVKKLGYT TGHIWACPPS EGDD YIFHC HPPDQKIPKP KRLQEWYKKM LDKAVSERIV HDYKDIFKQA TEDRLTSAKE LPYFEGDFWP NVLEESIKEL EQEEE ERKR EENTSNESTD VTKGDSKNAK KKNNKKTSKN KSSLSRGNKK KPGMPNVSND LSQKLYATME KHKEVFFVIR LIAGPA ANS LPPIVDPDPL IPCDLMDGRD AFLTLARDKH LEFSSLRRAQ WSTMCMLVEL HTQSQD UniProtKB: Histone acetyltransferase p300 |
-分子 #2: Cellular tumor antigen p53
| 分子 | 名称: Cellular tumor antigen p53 / タイプ: protein_or_peptide / ID: 2 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 29.898908 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: PLSSSVPSQK TYQGSYGFRL GFLHSGTAKS VTCTYSPALN KMFCQLAKTC PVQLWVDSTP PPGTRVRAMA IYKQSQHMTE VVRRCPHHE RCSDSDGLAP PQHLIRVEGN LRVEYLDDRN TFRHSVVVPY EPPEVGSDCT TIHYNYMCNS SCMGGMNRRP I LTIITLED ...文字列: PLSSSVPSQK TYQGSYGFRL GFLHSGTAKS VTCTYSPALN KMFCQLAKTC PVQLWVDSTP PPGTRVRAMA IYKQSQHMTE VVRRCPHHE RCSDSDGLAP PQHLIRVEGN LRVEYLDDRN TFRHSVVVPY EPPEVGSDCT TIHYNYMCNS SCMGGMNRRP I LTIITLED SSGNLLGRNS FEVRVCACPG RDRRTEEENL RKKGEPHHEL PPGSTKRALP NNTSSSPQPK KKPLDGEYFT LQ IRGRERF EMFRELNEAL ELKDAQAG UniProtKB: Cellular tumor antigen p53 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 279 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI POLARA 300 |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI EAGLE (4k x 4k) / 平均露光時間: 1.0 sec. / 平均電子線量: 15.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 150.0 µm / 最大 デフォーカス(補正後): 4.5 µm / 最小 デフォーカス(補正後): 1.7 µm / 倍率(補正後): 78894 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 最大 デフォーカス(公称値): 4.5 µm / 最小 デフォーカス(公称値): 1.7 µm / 倍率(公称値): 59000 |
| 試料ステージ | 試料ホルダーモデル: GATAN 910 MULTI-SPECIMEN SINGLE TILT CRYO TRANSFER HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Tecnai Polara / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Chain ID: A / Chain - Residue range: 1046-1664 / Chain - Source name: PDB / Chain - Initial model type: experimental model |
|---|---|
| 得られたモデル |  PDB-5xzc: |
 ムービー
ムービー コントローラー
コントローラー











































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)