+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6618 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the full-length TRPV2 channel by cryoEM | |||||||||
 マップデータ マップデータ | Structure of full-Length TRPV2 after signal subtraction 3D classification | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | TRPV2 / ion channel | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報transport / growth cone membrane / TRP channels / response to temperature stimulus / positive regulation of calcium ion import / calcium ion import across plasma membrane / endomembrane system / positive regulation of axon extension / monoatomic cation channel activity / axonal growth cone ...transport / growth cone membrane / TRP channels / response to temperature stimulus / positive regulation of calcium ion import / calcium ion import across plasma membrane / endomembrane system / positive regulation of axon extension / monoatomic cation channel activity / axonal growth cone / calcium channel activity / melanosome / lamellipodium / positive regulation of cold-induced thermogenesis / cell body / negative regulation of cell population proliferation / axon / cell surface / identical protein binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
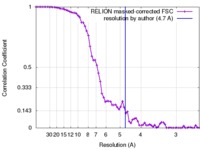
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.7 Å | |||||||||
 データ登録者 データ登録者 | Huynh KW / Cohen MR / Jiang J / Samanta A / Lodowski DT / Zhou ZH / Moiseenkova-Bell VY | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2016 ジャーナル: Nat Commun / 年: 2016タイトル: Structure of the full-length TRPV2 channel by cryo-EM. 著者: Kevin W Huynh / Matthew R Cohen / Jiansen Jiang / Amrita Samanta / David T Lodowski / Z Hong Zhou / Vera Y Moiseenkova-Bell /  要旨: Transient receptor potential (TRP) proteins form a superfamily Ca(2+)-permeable cation channels regulated by a range of chemical and physical stimuli. Structural analysis of a 'minimal' TRP vanilloid ...Transient receptor potential (TRP) proteins form a superfamily Ca(2+)-permeable cation channels regulated by a range of chemical and physical stimuli. Structural analysis of a 'minimal' TRP vanilloid subtype 1 (TRPV1) elucidated a mechanism of channel activation by agonists through changes in its outer pore region. Though homologous to TRPV1, other TRPV channels (TRPV2-6) are insensitive to TRPV1 activators including heat and vanilloids. To further understand the structural basis of TRPV channel function, we determined the structure of full-length TRPV2 at ∼5 Å resolution by cryo-electron microscopy. Like TRPV1, TRPV2 contains two constrictions, one each in the pore-forming upper and lower gates. The agonist-free full-length TRPV2 has wider upper and lower gates compared with closed and agonist-activated TRPV1. We propose these newly revealed TRPV2 structural features contribute to diversity of TRPV channels. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6618.map.gz emd_6618.map.gz | 25.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6618-v30.xml emd-6618-v30.xml emd-6618.xml emd-6618.xml | 10.5 KB 10.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_6618_fsc.xml emd_6618_fsc.xml | 6.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_6618.png emd_6618.png | 86.4 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6618 http://ftp.pdbj.org/pub/emdb/structures/EMD-6618 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6618 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6618 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_6618_validation.pdf.gz emd_6618_validation.pdf.gz | 392.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_6618_full_validation.pdf.gz emd_6618_full_validation.pdf.gz | 391.9 KB | 表示 | |
| XML形式データ |  emd_6618_validation.xml.gz emd_6618_validation.xml.gz | 9.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6618 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6618 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6618 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6618 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6618.map.gz / 形式: CCP4 / 大きさ: 26.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6618.map.gz / 形式: CCP4 / 大きさ: 26.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Structure of full-Length TRPV2 after signal subtraction 3D classification | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.29 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Recombinant rat full-length TRPV2
| 全体 | 名称: Recombinant rat full-length TRPV2 |
|---|---|
| 要素 |
|
-超分子 #1000: Recombinant rat full-length TRPV2
| 超分子 | 名称: Recombinant rat full-length TRPV2 / タイプ: sample / ID: 1000 / 詳細: The sample was monodisperse / 集合状態: tetramer / Number unique components: 1 |
|---|---|
| 分子量 | 実験値: 600 KDa / 理論値: 340 KDa / 手法: gel filtration |
-分子 #1: Transient Receptor Potential Cation Channel, Subfamily V, Member 2
| 分子 | 名称: Transient Receptor Potential Cation Channel, Subfamily V, Member 2 タイプ: protein_or_peptide / ID: 1 / Name.synonym: TRPV2 / コピー数: 4 / 集合状態: tetramer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 実験値: 600 KDa / 理論値: 340 KDa |
| 組換発現 | 生物種:  |
| 配列 | UniProtKB: Transient receptor potential cation channel subfamily V member 2 GO: transport InterPro: Transient receptor potential cation channel subfamily V member 2 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2.5 mg/mL |
|---|---|
| 緩衝液 | pH: 8 / 詳細: 0.064 mM DMNG, 150 mM NaCl, 20 mM HEPES, 1.0 mM DTT |
| グリッド | 詳細: Quantifoil R2/1 400 mesh copper grid |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 120 K / 装置: HOMEMADE PLUNGER / 手法: Blotted twice. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| アライメント法 | Legacy - 非点収差: Objective lens astigmatism was corrected at 100,000 times magnification. |
| 日付 | 2014年1月12日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 実像数: 988 詳細: Every image is the average of 14 frames recorded by the direct electron detector. |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 31000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー