+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the double mutant H84V/E120G of the flotillin-associated rhodopsin PsFAR in detergent micelle | ||||||||||||
 マップデータ マップデータ | Sharpened map used for manual and automatic refinement | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | proton transport / retinal / bioenergetics / microbial rhodopsin / MEMBRANE PROTEIN | ||||||||||||
| 生物種 |  Candidatus Pseudothioglobus sp. (バクテリア) Candidatus Pseudothioglobus sp. (バクテリア) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.81 Å | ||||||||||||
 データ登録者 データ登録者 | Kovalev K / Stetsenko A / Guskov A | ||||||||||||
| 資金援助 |  オランダ, オランダ,  ドイツ, 3件 ドイツ, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2025 ジャーナル: Structure / 年: 2025タイトル: Structural basis for no retinal binding in flotillin-associated rhodopsins. 著者: Kirill Kovalev / Artem Stetsenko / Florian Trunk / Egor Marin / Jose M Haro-Moreno / Gerrit H U Lamm / Alexey Alekseev / Francisco Rodriguez-Valera / Thomas R Schneider / Josef Wachtveitl / Albert Guskov /    要旨: Rhodopsins are light-sensitive membrane proteins capturing solar energy via a retinal cofactor covalently attached to a lysine residue. Several groups of rhodopsins lack the conserved lysine and ...Rhodopsins are light-sensitive membrane proteins capturing solar energy via a retinal cofactor covalently attached to a lysine residue. Several groups of rhodopsins lack the conserved lysine and showed no retinal binding. Recently, flotillin-associated rhodopsins (FArhodopsins or FARs) were identified and suggested to lack the retinal-binding pocket despite preserving the lysine residue in many members of the group. Here, we present cryoelectron microscopic (cryo-EM) structures of paralog FArhodopsin and proteorhodopsin from marine bacterium Pseudothioglobus, both forming pentamers similar to those of other microbial rhodopsins. We demonstrate no binding of retinal to the FArhodopsin despite preservation of the lysine residue and overall similarity of the protein fold and internal organization to those of the retinal-binding paralog. Mutational analysis confirmed that two amino acids, H84 and E120, prevent retinal binding within the FArhodopsin. Our work provides insights into the natural retinal loss in microbial rhodopsins and might contribute to the further understanding of FArhodopsins. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_53521.map.gz emd_53521.map.gz | 59.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-53521-v30.xml emd-53521-v30.xml emd-53521.xml emd-53521.xml | 18.7 KB 18.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_53521.png emd_53521.png | 66.7 KB | ||
| Filedesc metadata |  emd-53521.cif.gz emd-53521.cif.gz | 5.9 KB | ||
| その他 |  emd_53521_additional_1.map.gz emd_53521_additional_1.map.gz emd_53521_half_map_1.map.gz emd_53521_half_map_1.map.gz emd_53521_half_map_2.map.gz emd_53521_half_map_2.map.gz | 31.1 MB 59.2 MB 59.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-53521 http://ftp.pdbj.org/pub/emdb/structures/EMD-53521 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-53521 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-53521 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_53521_validation.pdf.gz emd_53521_validation.pdf.gz | 875.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_53521_full_validation.pdf.gz emd_53521_full_validation.pdf.gz | 874.8 KB | 表示 | |
| XML形式データ |  emd_53521_validation.xml.gz emd_53521_validation.xml.gz | 12.4 KB | 表示 | |
| CIF形式データ |  emd_53521_validation.cif.gz emd_53521_validation.cif.gz | 14.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-53521 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-53521 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-53521 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-53521 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_53521.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_53521.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened map used for manual and automatic refinement | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.836 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Non-sharpened map used for validation against model
| ファイル | emd_53521_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Non-sharpened map used for validation against model | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map B
| ファイル | emd_53521_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map A
| ファイル | emd_53521_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : flotillin-associated rhodopsin
| 全体 | 名称: flotillin-associated rhodopsin |
|---|---|
| 要素 |
|
-超分子 #1: flotillin-associated rhodopsin
| 超分子 | 名称: flotillin-associated rhodopsin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: double mutant form of flotillin-associated rhodopsin PsFAR with recovered retinal binding |
|---|---|
| 由来(天然) | 生物種:  Candidatus Pseudothioglobus sp. (バクテリア) Candidatus Pseudothioglobus sp. (バクテリア) |
| 分子量 | 理論値: 150 KDa |
-分子 #1: flotillin-associated rhodopsin
| 分子 | 名称: flotillin-associated rhodopsin / タイプ: protein_or_peptide / ID: 1 / コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Candidatus Pseudothioglobus sp. (バクテリア) Candidatus Pseudothioglobus sp. (バクテリア) |
| 分子量 | 理論値: 27.407168 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MNSTLLPTDI VGGTFWLLSM ALIGASIFFL LERNRVDGRW HTTMTLLGVT MLISAIFYYY VQGMWVDTGK APIVLRYLDW ILTVSMQVV MFYVILTAVT KVSSALFWRL LIGALVMVIG GFLGAAGYMS ATLGFIIGVV GWLYILGEIY MGEASRCNIE S GNEATHMA ...文字列: MNSTLLPTDI VGGTFWLLSM ALIGASIFFL LERNRVDGRW HTTMTLLGVT MLISAIFYYY VQGMWVDTGK APIVLRYLDW ILTVSMQVV MFYVILTAVT KVSSALFWRL LIGALVMVIG GFLGAAGYMS ATLGFIIGVV GWLYILGEIY MGEASRCNIE S GNEATHMA FNGLRLILTI GWAIYPLGYF INNLGGGVDA NSLNIIYNLT DFLNKIIFGF VVYRAAMNDT QARLDEIKKL EH HHHHH |
-分子 #2: EICOSANE
| 分子 | 名称: EICOSANE / タイプ: ligand / ID: 2 / コピー数: 66 / 式: LFA |
|---|---|
| 分子量 | 理論値: 282.547 Da |
| Chemical component information |  ChemComp-LFA: |
-分子 #3: RETINAL
| 分子 | 名称: RETINAL / タイプ: ligand / ID: 3 / コピー数: 5 / 式: RET |
|---|---|
| 由来(天然) | 生物種:  Candidatus Pseudothioglobus sp. (バクテリア) Candidatus Pseudothioglobus sp. (バクテリア) |
| 分子量 | 理論値: 284.436 Da |
| Chemical component information | 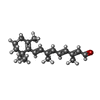 ChemComp-RET: |
-分子 #4: water
| 分子 | 名称: water / タイプ: ligand / ID: 4 / コピー数: 45 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 7.5 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| グリッド | モデル: Quantifoil / 材質: GOLD / メッシュ: 300 |
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 288 K / 装置: FEI VITROBOT MARK IV / 詳細: Blotting 4-6 seconds, blotting force 0. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)












































